
| ||


科目:高中化学 来源: 题型:
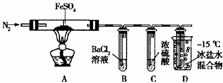
| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间N2加热 | A中固体变为红棕色,B中有白色沉淀生成,D试管中有无色液体生成 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将重所得溶液滴入D试管中 | 混合溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、22.3mL |
| B、22.30mL |
| C、23.65mL |
| D、23.4 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2:1 |
| B、1:2:3 |
| C、2:3:1 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强p(Pa) | 2×105 | 5×105 | 1×106 |
| c(A)mol/L | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
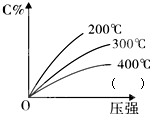 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡右移 |
| C、达平衡后,增加A的量有利于平衡向右移动 |
| D、化学方程式中n>e+f |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3(m-n) | ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
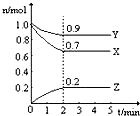 某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )
某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )| A、3X+Y?2Z; 0.05 mol/(L?min) |
| B、2X+Y?2Z; 0.1 mol/(L?min) |
| C、3X+Y?2Z; 0.1 mol/(L?min) |
| D、X+3Y?2Z; 0.05 mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com