
【题目】下列不属于等电子体的是( )
A.N2和 COB.CO2和N2O
C.PH3和NH3D.CO2和SiO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】相同质量的铝分别投入足量的下列物质中反应生成氢气,消耗溶质物质的量最少的是
A. 稀硫酸 B. 稀盐酸 C. 氢氧化钡溶液 D. 氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:

(1)装置A中反应的化学方程式为_____。
(2)设计实验:利用装置A中产生的气体证明+4价硫具有氧化性:_____。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、C、__、__、D、F,其中装置C的作用是_____,通过___________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A残液中SO2的含量。量取 1mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2=H2SO4),然后用0.1000mol/LNaOH标准溶液进行滴定,至终点时消耗NaOH溶20.00mL。

①G中球形冷凝管的冷凝水进口为_____(填“a”或“b”)。
②残液中SO2含量为____g/L。
③经多次测定发现,测定值始终高于实际值,则其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_________________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:

①下列说法正确的是________ (填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________。
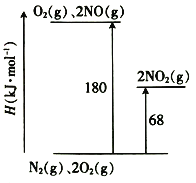
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是__________(填“a”或“b”);反应2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反应2NO(g)+O2(g) ![]() 2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
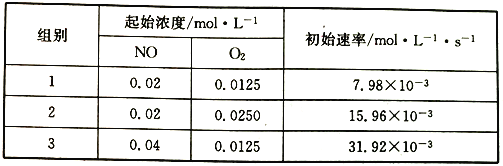
则k1=______________,m=______________,n=______________,
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是________(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。
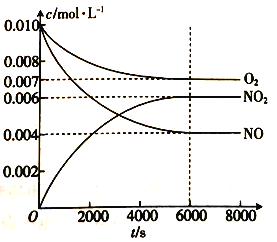
①NO的平衡转化率为 _______________。
②该温度下反应2NO(g)+O2(g)![]() 2NO2(g)的平衡常数为______________(保留整数)
2NO2(g)的平衡常数为______________(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+B(g) ![]() 3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的CO、NO、NO2、SO2都能使人中毒,其中易与人体中的血红蛋白结合,使血红蛋白失去运载O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习中经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2气体 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 锌粒放入硫酸亚铁溶液中 Zn+Fe2+=Zn2++Fe | 钠投入硫酸铜溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有A、B、X、Y、Z五种短周期元素,原子序数依次增大。它们的性质或原子结构如下表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含量最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素 |
Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
①X元素在元素周期表中的位置是______________;
②Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为___________________________________________________;
③化合物甲由A和B两种元素组成且质量比为3:14,甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示
X | ||
Y | ||
Z |
①X元素单质的化学式是_________,若X核内中子数与质子数相等,则X单质的摩尔质量为________;
②Y单质的电子式是_________;Z与钙形成的化合物的电子式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com