
| A. | 向Ca(ClO)2溶液中通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO3↓+Cl-+2HClO | |
| B. | 1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O |
分析 A.发生氧化还原反应生成硫酸钙;
B.1:1反应生成沉淀,1:4反应生成铝离子,而物质的量比为1:2.5,反应生成氢氧化铝和铝离子;
C.氯气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,n(FeBr2)=0.2L×2mol/L=0.4mol,由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化;
D.发生氧化还原反应生成硝酸铁、NO和水.
解答 解:A.向Ca(ClO)2溶液中通入少量SO2的离子反应为Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO,故A错误;
B.1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积均匀混合的离子反应为2AlO2-+5H+═Al(OH)3↓+Al3++H2O,故B正确;
C.氯气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,n(FeBr2)=0.2L×2mol/L=0.4mol,由电子守恒可知,离子反应为4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl-,故C错误;
D.氢氧化亚铁溶于稀硝酸中的离子反应为3Fe(OH)2+NO3-+10H+═3Fe3++NO↑+8H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+.Cl-.HCO3-.K+ | B. | Na+.Al3+.Cl-.SO42- | ||
| C. | NH4+.SO32-.Na+ NO3- | D. | Na+.SO42-.[Al(OH)4]-.OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在Kw/c(OH-)=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1 mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
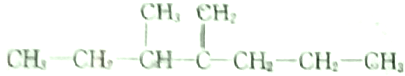 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯 ,可命名为1-甲基-3-乙基苯.
,可命名为1-甲基-3-乙基苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质在固态时均为离子晶体 | |
| B. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| C. | 用道尔顿的原子结构理论无法解释同位素现象 | |
| D. | 晶体类型相同,则晶体中化学键也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
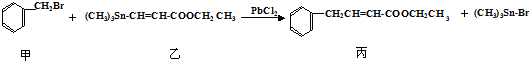
| A. | 分离提纯有机物丙宜在NaOH热溶液中进行 | |
| B. | PbCl2的作用是提高反应物的活性,加快反应速率 | |
| C. | 可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 | |
| D. | 利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com