
分析 (1)依据2H2O?OH-+H3O+,类推结合题干信息写出液态NH3电离方程式;
(2)依据溶液中氢氧根离子浓度为为0.01mol/L,溶液的pH为11,溶液中氢离子浓度为10-11mol/L,结合离子积概念Kw=c(H+).c(OH-)计算;依据计算出的离子积,依据酸碱反应定量关系分析判断;
(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则c(H+)=1.0×10-2mol/L,c(OH-)=1.0×10-12mol/L,说明HA是弱酸,加水稀释HA溶液,促进HA电离平衡正向移动,水的离子积常数只受温度影响,据此分析.
解答 解:(1)依据2H2O?OH-+H3O+,可知液体氨气部分电离出铵根离子和氨基负离子,电离方程式:2NH3?NH4++NH2-,
故答案为:2NH3?NH4++NH2-;
(2)溶液中氢氧根离子浓度为为0.01mol/L,溶液的pH为11,溶液中氢离子浓度为10-11mol/L,该温度下水的离子积Kw=0.01mol/L×10-11mol/L=1.0×10-13;在此温度下,将pH=a的H2SO4溶液Va L与pH=b的NaOH溶液Vb L混合,若所得混合液为中性,说明氢氧根离子和氢离子恰好反应,Va L×10-amol/L=Vb L×$\frac{1.0×1{0}^{-13}}{1{0}^{-b}}$mol/L,Va:Vb=1:1013-a-b;
且a+b=12,解得Va:Vb=1:10,
故答案为:1.0×10-13;1:10;
(3)①25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则c(H+)=1.0×10-2mol/L,c(OH-)=1.0×10-12mol/L,说明HA是弱酸,
故答案为:弱电解质;
②A.n(H+)和n(A-)增大,n(HA)减小,V变大,c(HA)减小,故A错误;
B.在加水稀释HA溶液的过程中,n(H+)和n(A-)增大,n(HA)减小,V变大,$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$ 减小,故B错误;
C.水的离子积常数只受温度影响,c(H+)与c(OH-)的乘积不变,故C错误;
D.弱酸HA加水稀释,溶液酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,故D正确;
故答案为:D.
点评 本题考查酸碱混合的计算、弱电解质判断、弱酸加水稀释时离子浓度的变化,明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质,题目难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | N的正反应速率是M的逆反应速率的3倍 | |
| B. | 恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 恒温下,扩大容器体积至原来的两倍,则N物质的量浓度大于0.6 mol/L | |
| D. | 恒温恒压下,增加Z的物质的量,重新达平衡时,N物质的量浓度大于0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
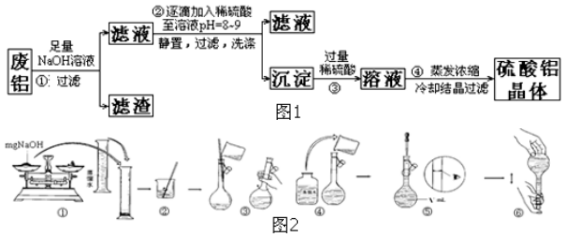
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于N2分子中的N≡N键能大,因此其沸点高于CH4 | |
| B. | 固体CH4中的化学键只有极性共价键 | |
| C. | 冥王星表面可能不会有大量O2存在 | |
| D. | CH4可以作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为5% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动 | |
| D. | 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用HF溶液做导电性实验,灯泡很暗 | |
| B. | HF与水能以任意比混溶 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 常温下NaF溶液的pH大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
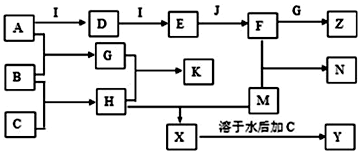
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C是氧化剂 | B. | N2被还原 | ||
| C. | Al2O3发生氧化反应 | D. | 生成1 mol AlN转移6 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com