
分析 用氨水吸收SO2 ,反应后只得到一种正盐,该正盐为亚硫酸铵,铵根离子部分水解,亚硫酸根离子的水解程度大于铵根离子的水解程度,则溶液呈碱性,c(H+)<c(OH-),(NH4)2SO3的化学式中含有2个铵根离子,且水解程度较小,则c(NH4+)>c(SO32-),据此判断溶液中各离子浓度大小.
解答 解:生成的正盐(NH4)2SO3溶液呈碱性,则c(H+)<c(OH-),由于(NH4)2SO3的化学式中含有2个铵根离子,且水解程度较小,则c(NH4+)>c(SO32-),溶液中氢氧根离子来自水的电离和亚硫酸氢根离子的水解,则c(OH-)>c(HSO3-),
所以溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、盐的水解原理、物料守恒在判断离子浓度大小中的应用方法.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
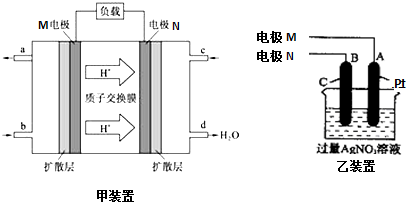
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.
.9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
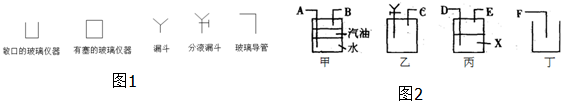
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤(简述操作过程) | 预期现象和结论 |
| ①测1.0mol/L Fe(NO3)3溶液的pH ② ③ ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-n=b+m | B. | 氢化物HnX或XHn | C. | a+n=b-m | D. | 化合物YnXm |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 原子半径:Na<Mg<Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com