
锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不正确的是( )
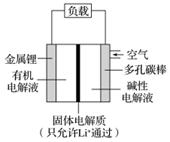
A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附
C.放电时,当有22.4 L O2(标准状况下)被还原时,溶液中有4 mol Li+从左槽移动到右槽
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O2===2Li2O
科目:高中化学 来源: 题型:
已知:锂离子电池的总反应为LixC+Li1-xCoO2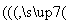 C+LiCoO2
C+LiCoO2
锂硫电池的总反应为2Li+S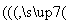 Li2S
Li2S
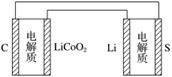
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
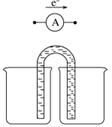
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是____________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
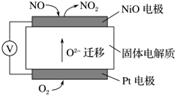
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
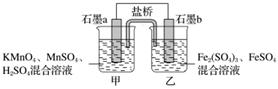
回答下列问题:
(1)此原电池的正极是石墨__________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO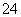 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲________________________________________________________________________;
乙________________________________________________________________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
硒(Se)与硫在元素周期表中位于同一主族。下列说法不正确的是
A.原子半径:Se > S B.沸点:H2S > H2Se
C.稳定性:H2S > H2Se D.酸性:H2SO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于工业生产的说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽一般用铁网作电极
D.合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
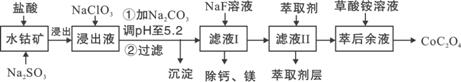 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
 (3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
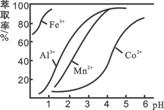
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取
剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com