
| A、32g O2气体含有的氧原子数为NA |
| B、2L 0.3mol/L Na2SO4溶液中含有Na+为0.6NA |
| C、27g铝完全反应后失去的电子数为3NA |
| D、11.2L氮气所含的分子数为0.5NA |
| m |
| M |
| 32g |
| 32g/mol |
| 27g |
| 27g/mol |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作及现象 | 实验结论 | |
| A | 向2mL 0.1mol?L-1 CH3COOH溶液中滴加等浓度的NaHCO3溶液,有气泡产生 | 酸性: CH3COOH>H2CO3 |
| B | 向2mL 0.1mol?L-1 NaOH溶液中滴加3滴0.1mol?L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol?L-1 FeCl3溶液,出现红褐色沉淀 | 溶度积: Mg(OH)2>Fe(OH)3 |
| C | 在少量无水乙醇中加入金属Na,生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4,又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
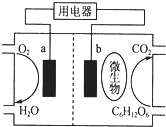 以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池结构如图所示.a为电池的正极,关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、b电极发生还原反应 |
| C、O2在a电极被氧化 |
| D、电流从a电极经用电器流向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B与A只能组成BA3化合物 |
| B、C、D、E形成的化合物水溶液可能显碱性 |
| C、A、B、C形成的化合物一定不能发生水解反应 |
| D、E的氧化物对应的水化物只具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
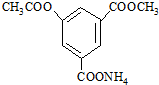 某有机物的结构简式如图所示,该物质1mol与足量NaOH溶液充分反应,消耗NaOH物质的量为( )
某有机物的结构简式如图所示,该物质1mol与足量NaOH溶液充分反应,消耗NaOH物质的量为( )| A、5mol | B、4mol |
| C、3mol | D、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
| A | 滴加氨水 | Na+、Al3-、Cl-、NO3- | 不能大量共存, Al3++3OH-═Al(OH)3↓ |
| B | 由水电离出的H+浓度为1×10-12mol?L-1 | NH4+、Na+、NO3-、Cl- | 一定能大量共存,NH4++H2O?MH3?H2O+H+ |
| C | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O |
| D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱金属的单质中,锂的还原性最强 |
| B、K与水反应最剧烈 |
| C、在自然界中它们无游离态存在 |
| D、单质的熔沸点依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com