
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A. | NH3溶于水形成的溶液微弱导电 | NH3是弱电解质 |
| B. | 氮气与氧气反应条件苛刻 | 氮元素的非金属性不强 |
| C. | 1体积水可以溶解700体积氨气 | 氢键的影响 |
| D. | HF的沸点高于HCl | H—F的键能比H—Cl的键能强 |
科目:高中化学 来源:不详 题型:单选题
| A.加热氯化铵与固化碘过程中发生的都是升华 |
| B.氢键的存在主要影响物质的物理性质,如熔沸点和在水中的溶解度 |
| C.水分子相当稳定是因为水分子间存在很强的分子间作用力 |
| D.直接由原子构成的晶体必然是原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.水合氢离子分子构型是三角锥型 | D.微粒中的键角发生了改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关 |
| B.[Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物 |
| C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| D.由下图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
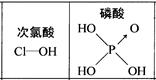
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.若X的原子序数是m,则Y的原子序数必定是m  4 4 |
| B.XY3晶体一定属于离子晶体 |
| C.X与Y可属于两个不同周期,也可属于同一周期 |
| D.X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都是直线形结构 |
| B.中心原子都采取sp杂化 |
| C.硫原子和碳原子上都没有孤电子对 |
| D.SO2为V形结构,CO2为直线形结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若n=2,则分子的立体结构为V形 |
| B.若n=3,则分子的立体结构为三角锥形 |
| C.若n=4,则分子的立体结构为正四面体形 |
| D.以上说法都不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com