
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
科目:高中化学 来源: 题型:选择题
| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | 向明矾[KAl(SO4)2•12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
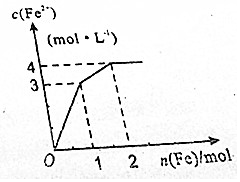 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2)/mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A. | 反应在20 min内的平均速率为v(H2)=0.04 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于$\frac{1}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Ca(OH)2 | C. | H2SO4 | D. | NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com