
| A、0.2mol NO和0.1mol NO2 |
| B、0.3 mol NO |
| C、0.1mol NO、0.2mol NO2和0.1mol N2O4 |
| D、0.3 mol NO2和0.1mol N2O4 |
| m |
| M |
| 11.6g |
| 58g/mol |
| 2.7g |
| 27g/mol |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
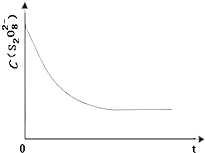 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气通过灼热的CuO粉末 |
| B、将锌粒投入CuSO4溶液 |
| C、CO2通过Na2O2粉末 |
| D、将铜片投入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 |
| B、由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 |
| C、由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒 |
| D、由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com