
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
分析 (1)先写出目标反应的热化学方程式,然后根据盖斯定律及已知热化学方程式,通过①-②可得目标反应的热化学方程式;
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,注意水的离子积常数只与温度有关;
(3)A.酸或碱抑制了水电离,含有弱根离子的盐促进水电离;
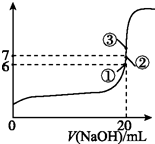
B.在①点时pH=6,溶液显示酸性,根据电荷守恒分析;
C.在②点时,溶液为中性,根据电荷守恒分析离子浓度大小;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电荷守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半;
(4)电离常数越大,酸性越强,其盐的水解能力越小,溶液的pH越小;
(5)设计实验使溶液中的CO32-由有到无,再根据酚酞的颜色变化起作用的是否是碳酸根离子;
(6)根据原子守恒确定A,再根据化合价变化计算转移电子.
解答 解:(1)①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1,
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,
结合盖斯定律①-②得到:HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1,
故答案为:HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1;
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,
A.稀释过程中促进氢氟酸电离,但c(H+)减小,故A错误;
B.温度不变,水的离子积常数不变,所以c(H+)•c(OH-)不变,故B错误;
C.稀释过程中促进氢氟酸电离,氢离子个数增大,氟化氢分子个数减小,所以$\frac{c({H}^{+})}{c(HF)}$增大,故C正确;
D.稀释过程中促进氢氟酸电离,氢离子浓度降低,氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D正确;
故答案为:CD;
(3)A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)不相等,故A错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故B正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)=c(Na+),故C正确;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故D错误;
故选BC;
(4)电离常数越大,酸性越强,其盐的水解能力越小,溶液的pH越小,所以酸性③>②>④>①,所以溶液的pH:①>④>②>③;
故答案为:①>④>②>③;
(5)为证明纯碱溶液呈碱性是由CO32-引起的,就设计一个使溶液中的碳酸根离子由有到无的实验,根据溶液中酚酞颜色的变化判断,所以设计的实验为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅,则说明Na2CO3溶液显碱性是因为CO32-水解的缘故,
故答案为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅;
(6)根据原子守恒知,该反应方程式为:HFO+H2O=HF+H2O2,根据元素化合价知,每生成1molHF转移 1mol电子,
故答案为:1.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、实验设计、氧化还原反应等知识点,题目难度中等,明确弱电解质电离平衡影响因素、溶液中电荷守恒、物料守恒及盐的水解原理为解答原理,注意掌握溶液酸碱混合的定性判断及溶液pH的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
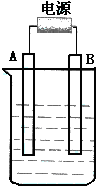 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
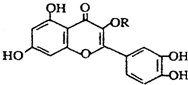
| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7molBr2完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g 18O2中含有的氧原子数是2×6.02×1023 | |
| B. | 1 mol N2和CO的混合气体中含有的分子总数是2×6.02×1023 | |
| C. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 | |
| D. | 1.0 L 0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
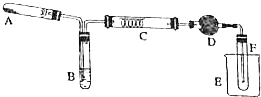 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com