
【题目】硫酸亚铁铵(NH4)aFeb(SO4)cdH2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:______。实验室检验“还原”已完全的方法是_______________。
(2) “还原”前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.40 |
Fe2+ | 0.05 | 2.15 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比______。
(3)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00 mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398 g;另取25.00 mL该溶液用0.0200 mol/L KMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式_________________(请写出计算过程)。
【答案】 FeS2 +2Fe3+ = 3Fe2++2S↓ 取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全 7:2 原样品中的n(SO42-)=10×1.398g÷233g/mol=0.06mol , n(MnO4-)=0. 0200mol/L×0.03L=0.000 6 mol ,由得失电子守恒可知:n(Fe2+)=5 n(MnO4-)=0.003mol ,原样品中n(Fe2+)=0.03 mol , 由电荷守恒可知:原样品中n(NH4+)=0. 06mol 由质量守恒:n(H2O)=0.18 mol ,故化学式为: (NH4)2Fe(SO4)26H2O或 (NH4)2SO4FeSO46H2O
【解析】本题主要考查对于“用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程”的评价。涉及Fe3+的氧化性等。
(1)“还原”时Fe3+与FeS2发生还原反应Ⅱ生成S,反应的离子方程式:FeS2 +2Fe3+ = 3Fe2++2S↓。实验室检验“还原”已完全就是检验Fe3+不存在,方法是取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全。
(2) “还原”前后溶液中c(Fe2+)的变化为2.10mol/L,c(![]() )的变化为0.20mol/L,对应反应I的c(Fe2+)的变化为1.50mol/L,其中还原而成Fe2+的浓度c(Fe2+)为1.40mol/L,反应II的c(Fe2+)的变化为(2.10-0.15)mol/L=0.60mol/L,其中还原而成Fe2+的浓度c(Fe2+)为0.40mol/L,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比1.40:0.40=7:2。
)的变化为0.20mol/L,对应反应I的c(Fe2+)的变化为1.50mol/L,其中还原而成Fe2+的浓度c(Fe2+)为1.40mol/L,反应II的c(Fe2+)的变化为(2.10-0.15)mol/L=0.60mol/L,其中还原而成Fe2+的浓度c(Fe2+)为0.40mol/L,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比1.40:0.40=7:2。
(3)原样品中n(SO42-)=10×1.398g÷233g/mol=0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为: (NH4)2Fe(SO4)26H2O或(NH4)2SO4FeSO46H2O。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):
![]()
![]()
![]()
![]()
![]()
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯和乙酸丁酯的描述中,正确的是
A.均采用水浴加热B.制备乙酸乙酯时乙醇过量
C.均采用边反应边蒸馏的方法D.制备乙酸丁酯时正丁醇过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成(部分反应条件略去):
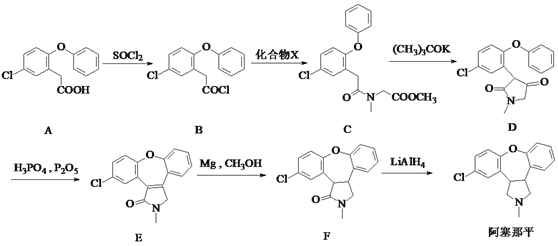
(1)阿塞那平中的含氧官能团为______________(填官能团的名称)。由F→阿塞那平的反应类型为____________。
(2)化合物X的分子式为C4H9NO2,则由B→C反应的另一产物的化学式___________。
(3)由D生成E的过程中先后发生加成反应和消去反应,则加成反应后中间体的结构简式为 ________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___________。
Ⅰ.属于芳香化合物,分子中含有酯基且只有5种不同化学环境的氢;
Ⅱ.能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(5)已知:![]() ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和![]() 为原料制备
为原料制备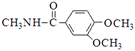 的合成路线流程图(无机试剂任用)。合成路线流程图示例如:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如:![]() _________________
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KC1O3,且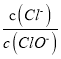 与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
A. 若某温度下,反应后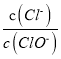 =11,则溶液中
=11,则溶液中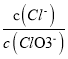 =
=![]()
B. 参加反应的氯气的物质的量等于![]() amol
amol
C. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
D. 改变温度,反应中转移电子的物质的量n的范围: ![]() amol≤n≤
amol≤n≤![]() amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①NaHCO3②(NH4)2S③Al(OH)3④NH4Cl⑤H2N-CH2-COOH ⑥CH3COOH
A. ①②③ B. ①②④⑤ C. ⑤⑥ D. ①②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com