
| A. | 28g乙烯(C2H4)中含有的π键数与13g乙炔(C2H2)中含有的π键数一样多 | |
| B. | 通过MnO2催化使H2O2分解,产生16g O2时转移电子数为2NA | |
| C. | 2.24L NH3中含共价键数目一定为0.3NA | |
| D. | 5.6g Fe投入100mL 3.5mol•L-1稀硝酸中,充分反应,转移电子总数为0.3 NA |
分析 A、1molC2H4中含1molπ键;1mol乙炔中含2molπ键;
B、求出氧气的物质的量,然后根据生成1mol氧气时转移2mol电子来分析;
C、氨气的状态不明确;
D、根据铁与硝酸的物质的量判断过量,然后计算出转移的电子数.
解答 解:A、28g乙烯的物质的量为1mol,而1molC2H4中含1molπ键即NA个;13g乙炔的物质的量为0.5mol,而1mol乙炔中含2molπ键,故0.5mol乙炔中含1molπ键即NA个,故A正确;
B、16g氧气的物质的量为0.5mol,而双氧水分解制的1mol氧气时转移2mol电子,故生成0.5mol氧气时转移1mol电子即NA个,故B错误;
C、氨气的状态不明确,故其物质的量无法计算,故C错误;
D、5.6g铁的物质的量为0.1mol,100mL 3.5mol•L-1稀硝酸的物质的量为0.35mol,根据反应Fe+4H++NO3-═Fe3++NO↑+2H2O可知,0.1mol铁完全反应生成铁离子,消耗硝酸的物质的量为4mol,显然硝酸不足,反应后有亚铁离子生成,所以转移的电子的物质的量小于0.3mol,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件、掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
| 装置示意图 | 现象及结论 |
| 有白色沉淀生成说明分解产物SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
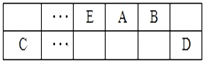
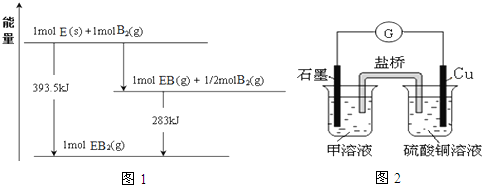
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲烷的质量与甲烷的摩尔质量相等 | |
| B. | 28 g氮气与40 g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3 g钠和过量氧气反应,失去的电子数为0.1NA | |
| D. | 18 g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于1.2mol•L-1 | B. | 小于1.2mol•L-1 | C. | 等于1.2mol•L-1 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com