
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B元素的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,因此B的电子排布为1s22s22p2,即B为碳元素;D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布为1s22s22p4,即D为氧元素;B、C、D的原子序数依次递增,因此C为N元素.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,因此M是甲醛.A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯.E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E的原子序数为18+4=22,即E为钛元素.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B元素的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,因此B的电子排布为1s22s22p2,即B为碳元素;D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布为1s22s22p4,即D为氧元素;B,、C、D的原子序数依次递增,因此C为N元素.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,因此M是甲醛.A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯.E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E的原子序数为18+4=22,即E为钛元素.
(1)A2D2分子是H2O2,含有极性键和非极性键的共价化合物,其电子式为 ;Ti的原子序数为22,根据构造原理可知,其电子基态电子排布为1s22s22p63s23p63d24s2,电子最后填充3d电子,则外围电子排布为3d24s2,
;Ti的原子序数为22,根据构造原理可知,其电子基态电子排布为1s22s22p63s23p63d24s2,电子最后填充3d电子,则外围电子排布为3d24s2,
故答案为: ;3d24s2;
;3d24s2;
(2)B、C、D三种元素分别为C、N、O,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;
(3)氮元素的最高价氧化物是硝酸,具有强氧化性,在加热的条件下浓硝酸能氧化单质碳,反应的化学方程式是:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)a.甲醛是平面三角形结构,但由于甲醛分子中共价键的极性不能抵消,所以甲醛是极性分子,而苯是平面正六边形结构,属于非极性分子,故a正确;
b.化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化.CO2是直线型结构,碳原子是sp杂化,故b错误;
c.苯分子中的碳碳键介于碳碳单键和碳碳双键之间的一种独特的键,所以苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2形成晶体类型是分子晶体,而二氧化硅是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确,
故选:ad;
(5)根据晶胞的结构可知,晶胞中含有Ti原子的个数=1+8×$\frac{1}{8}$=2,氧原子个数=2+4×$\frac{1}{2}$=4,所以Q的化学式是TiO2.根据盖斯定律可知,①+②即得到反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g),所以该反应的反应热△H=+140kJ/mol-221kJ/mol=-81kJ/mol,
反应热化学方程式为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol;
(6)①合成氨反应是放热反应,所以升高温度平衡向逆反应方向移动,因此平衡常数减小,即K1>K2,
故答案为:>;
②当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,它们的浓度分别是6mol/L、2mol/L、4mol/L,则根据平衡常数表达式可知,此时$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})×c({N}_{2})}$=$\frac{{6}^{2}}{{4}^{3}×2}$=$\frac{9}{32}$<0.5,所以反应向正反应方向移动,即 V(N2)正>(N2)逆,
故答案为:>.
点评 本题考查元素周期表的结构和元素周期律的应用、核外电子排布、第一电离能、分子的空间构型、化学键、晶体类型与性质、晶胞计算计算、热化学方程式书写、平衡常数的应用和外界条件对平衡状态的影响等,题目比较综合,是对学生综合能力的考查,难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
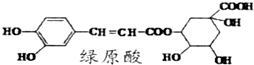
| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
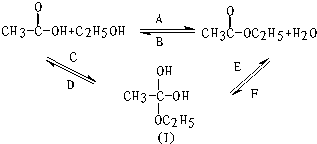 如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.
如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.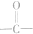 )或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
)或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
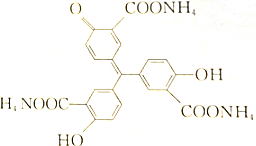 对于如图所示化合物,下列说法中错误的是( )
对于如图所示化合物,下列说法中错误的是( )| A. | 该化合物的化学式为C22H23O9N3 | |
| B. | 分子内已有3个羧基被氨中和,故完全反应1mol该化合物还需2molNaOH | |
| C. | 该化合物可与FeCl3发生显色反应,不与银氨溶液反应 | |
| D. | 每1mol该化合物可与5molBr2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Na2O | B. | KClO NaOH | C. | Br2 HBr | D. | HF H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与水反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁与盐酸反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | B. | 基态氧原子L层电子排布图: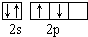 | ||
| C. | CH4分子中只有σ键 | D. | HClO的结构式:H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com