
【题目】下列营养物质中,属于高分子的是
A. 蔗糖 B. 油脂 C. 蛋白质 D. 葡萄糖
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4=FeSO4+Cu。有关该反应的说法正确的是 ( )
A. Fe被氧化 B. CuSO4是还原剂
C. Fe是氧化剂 D. CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
原子或分子相关信息 | 单质及其化合物相关信息 | |
X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
回答下列问题:
(1)W在周期表的位置为 , W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为 .
(2)X的简单阴离子的结构示意图为;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 .
(3)Z的氧化物在通讯领域的用途是 , 工业上制备Z的单质的化学反应方程式为 .
(4)YX3固体在熔融状态下不导电,则YX3固体中存在键;在50mL 1molL﹣1的YX3溶液中逐滴加入0.5molL﹣1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有种情况.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存,且强酸性溶液中也能大量共存的一组是
A. K+、Na+、ClO―、SO42― B. Mg2+、Al3+、NO3―、SO42―
C. Na+、CO32―、Cu2+、K+ D. Fe2+、K+、Cl―、NO3―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A. 铁+稀盐酸 B. 铜+稀盐酸 C. 银+稀盐酸 D. 铜+硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L﹣1的两种气体X2和Y2,在密闭容器中发生反应生成气体Z,反应2min后,测得参加反应的X2的浓度为0.6mol·L﹣1,用Y2的浓度变化表示的化学反应速率v(Y2)=0.1mol·L﹣1·min﹣1,生成的c(Z)为0.4mol/L.则该反应的化学方程式是( )
A. X2+2Y2![]() 2Z B. 2X2+Y2
2Z B. 2X2+Y2![]() 2Z C. 3X2+Y2
2Z C. 3X2+Y2![]() 2Z D. X2+3Y2
2Z D. X2+3Y2![]() 2Z
2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第33号元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在元素周期表中的位置是__________________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_________________________________________。该反应需要在加压下进行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
则反应 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K时,将20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
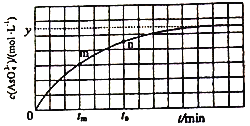
①下列不能判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时v逆 ______tn时v逆(填“>”“<”或“=”),理由是_____________。
③若平衡时溶液的c(OH-)=lmol/L,则该反应的平衡常数K为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示. 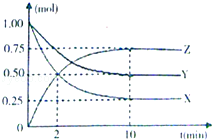
根据图中数据,完成下列问题:
(1)该反应的化学方程;
(2)反应开始至2min,气体Z的平均反应速率为;
(3)若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是 .
(4)达到平衡后,下列说法不正确的是
A.X、Y、Z的浓度之比是1:2:3
B.X的消耗速率和Y的生成速率相等
C.Z的浓度保持不变
D.升高温度重新达到平衡,Z的浓度减小,则该反应为吸热反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com