
【题目】(1)向K2Cr2O7的水溶液中加入Ba(NO3)2溶液,产生难溶性黄色沉淀BaCrO4,说明K2Cr2O7的水溶液中存在如下平衡:__________________________________________,产生沉淀后溶液PH变________.已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色,往上述溶液中加入氢氧化钠溶液呈_________色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动。
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应的离子反应方程式:____________________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用 B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用 D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | <>2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________淀粉溶液的作用是____________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,试推测该实验结论: ____________
【答案】Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq)小黄橙减弱溶液紫色褪色时间5H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2OC其他条件不变,探究浓度对化学反应速率的影响显色剂,检验I2的存在4.0t1<t2<t3其它条件不变,增大浓度加快反应速率
2CrO42-(aq)+ 2H+(aq)小黄橙减弱溶液紫色褪色时间5H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2OC其他条件不变,探究浓度对化学反应速率的影响显色剂,检验I2的存在4.0t1<t2<t3其它条件不变,增大浓度加快反应速率
【解析】
(1)向K2Cr2O7的水溶液中加入Ba(NO3)2溶液,产生难溶性黄色沉淀BaCrO4,说明CrO42-存在于生成物中,因此K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq);产生沉淀后溶液中氢离子浓度增大,溶液PH变小;根据Cr2O72-(aq)+ H2O(l)
2CrO42-(aq)+ 2H+(aq);产生沉淀后溶液中氢离子浓度增大,溶液PH变小;根据Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq)反应可知,往上述溶液中加入氢氧化钠溶液,减小了氢离子浓度,平衡右移,CrO42-浓度增大,溶液呈黄;再加入过量硫酸溶液,增加了氢离子浓度,平衡左移,Cr2O72-浓度增大,溶液呈橙色; 通过以上实验可以说明如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动;综上所述,本题答案是:Cr2O72-(aq)+ H2O(l)
2CrO42-(aq)+ 2H+(aq)反应可知,往上述溶液中加入氢氧化钠溶液,减小了氢离子浓度,平衡右移,CrO42-浓度增大,溶液呈黄;再加入过量硫酸溶液,增加了氢离子浓度,平衡左移,Cr2O72-浓度增大,溶液呈橙色; 通过以上实验可以说明如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动;综上所述,本题答案是:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq); 小; 黄; 橙;减弱。
2CrO42-(aq)+ 2H+(aq); 小; 黄; 橙;减弱。
(2)在KMnO4与H2C2O4发生氧化还原反应,高锰酸钾溶液紫色逐渐褪去,因此可通过测定溶液紫色褪色时间来测定该反应的速率;酸性条件下KMnO4被还原为Mn2+,H2C2O4被氧化为二氧化碳,反应的离子反应方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2O;此反应开始反应缓慢,随后反应迅速加快,其原因是:
A.由于反应开始时溶液中氢离子就存在,反应速率比较慢,说明氢离子不是反应速率加快的原因,错误;
B.生成的CO2逸出,使生成物浓度降低,反应速率减小,错误;
C.反应中,生成的Mn2+起催化作用,由于刚开始时,锰离子浓度较小,速率慢,随着反应的进行,锰离子浓度增大,锰离子对反应具有催化作用,反应速率加快,正确;
D.在酸性条件下KMnO4的氧化性增强,反应开始时反应速率就应很快,不符合此反应开始反应缓慢,随后反应迅速加快规律,错误;综合以上分析,符合题意的选项C。
综上所述,本题答案是:溶液紫色褪色时间 ;H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2O,C。
(3)①为了探究浓度对化学反应速率的影响,实验中Na2S2O3溶液浓度不同;淀粉作为显色剂,检验碘的存在,可根据溶液颜色的变化判断反应进行的快慢;综上所述,本题答案是:其他条件不变,探究浓度对化学反应速率的影响;显色剂,检验I2的存在。
②应保持其他影响因素一致,即应使溶液的体积均为16 mL,故Vx=4.0mL;由于在三个实验中Na2S2O3溶液的体积为①>②>③,而混合后溶液体积相同,故混合后Na2S2O3溶液的浓度为①>②>③,可知化学反应速率①>②>③,反应所需要时间的大小t1<t2<t3;得出结论是:其它条件不变,反应物浓度越大,化学反应速率越快;综上所述,本题答案是: 4.0, t1<t2<t3 ;其它条件不变,增大浓度加快反应速率。


科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系图。C具有果香味。

根据以上信息及各物质的转化关系完成下列各题:
(1)A的结构简式为_______,工业上用乙烯生产A的化学方程式为__________。
(2)B的官能团名称为_____,B可与纯碱溶液反应,写出该反应方程式_____________。
(3)A+B→C的化学方程式为__________,反应类型为_________反应。
(4)下列说法正确的是_______。
a.上述有机物中只有C6H12O6属于糖类物质
b.物质A和B都属于电解质
c.物质C和油脂类物质互为同系物
d.转化1可在人体内完成,该催化剂属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】劣质洗发水中含有超标致癌物二噁烷![]() 。关于该化合物的说法正确的是
。关于该化合物的说法正确的是
A. 与 1,4-丁二醇(CH2OHCH2CH2CH2OH)互为同分异构体
B. l mol 二噁烷完全燃烧消耗 5molO2
C. 分子中所有原子均处于同一平面
D. 一氯代物有 4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )
A.CO32-、Cl-B.NO3-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
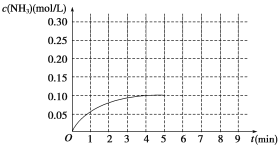
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关二氧化硅的叙述正确的是( )
A.二氧化硅不与任何酸反应
B.二氧化硅能与水反应生成硅酸
C.二氧化硅是酸性氧化物,能与烧碱溶液反应
D.二氧化硅是两性氧化物,能与碱和氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com