
【题目】回答下列问题:(均用NA表示阿伏伽德罗常数的值)
(1)0.1molAl2(SO4)3中含有离子总数为 个,Al3+的质量是 ,SO42-的物质的量是 ;
(2)若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是 g;
(3)将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是 ;
(4)现有14.4g CO和CO2的混合气体,在标准状况下其体积为8.96L;
①该混合气体的平均摩尔质量为 ;
②混合气体中碳原子的个数为 。
【答案】(1)0.5NA;5.4g;0.3mol(2)M/NAg
(3)![]() molL﹣1(4)36g/mol;0.4NA
molL﹣1(4)36g/mol;0.4NA
【解析】
试题分析:(1)0.1molAl2(SO4)3中含有0.2mol![]() 、0.3mol
、0.3mol![]() ;离子总数为0.5 NA 个,Al3+的质量是
;离子总数为0.5 NA 个,Al3+的质量是![]() 5.4 g,SO42-的物质的量是0.3mol;(2)若某原子的摩尔质量是M g /mol,则1mol原子的质量是Mg,1mol原子数是NA 个,一个该原子的真实质量是M/NA g;(3)将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是
5.4 g,SO42-的物质的量是0.3mol;(2)若某原子的摩尔质量是M g /mol,则1mol原子的质量是Mg,1mol原子数是NA 个,一个该原子的真实质量是M/NA g;(3)将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是 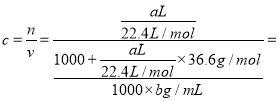
![]() molL﹣1;(4)①设该混合气体的平均摩尔质量为M,
molL﹣1;(4)①设该混合气体的平均摩尔质量为M,![]() ,M=36g/mol;②混合气体的物质的量是
,M=36g/mol;②混合气体的物质的量是![]() ,碳原子的个数为0.4NA。
,碳原子的个数为0.4NA。


科目:高中化学 来源: 题型:
【题目】战国所著《周礼》中记载沿海古人“谋饼烧蛎房成灰”(“ 蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第—步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A. CaO B. Ca(OH)2 C. SiO2 D. Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,反应2HBr(g) H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合气体的颜色加深,且使Br2的百分含量保持不变,可采取的方法是( )
A. 减小压强 B. 增大氢气浓度 C. 升高温度 D. 缩小体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是一种重要的化工产品,利用氨碱法生产纯碱的流程如下图所示。

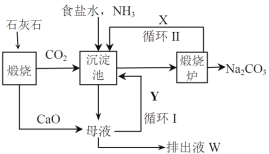
(1)沉淀池中发生反应的化学方程式为___________________;
(2)X是________,Y是_______(填化学式);
(3)排出液W中的溶质除了氢氧化钙外,还有_______、________;(至少两种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般说来,每100克蛋白质平均含氮为16克,这些氮主要存在于蛋白质的 ( )
A. —CO—NH— B. 游离的氨基 C. 游离的羧基 D. R基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ、Ⅱ中正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
正极电极反应式为______________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu===2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为_____________,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为_____________g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的总反应化学方程式是:________________。
②电池工作一段时间后硫酸溶液的浓度_____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com