
 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,W为F元素,Z为O元素,Y为
N元素,A为Cl元素,B为S元素,结合元素周期律与物质的性质等解答.
(1)B为S元素,主族元素周期数=电子层数,族序数等于最外层电子数;
(2)同周期从左向右,非金属性逐渐增强,非金属性越强,氢化物越稳定;
(3)生活中最常用的过渡金属单质为铁,在O2中点燃生成四氧化三铁,为确定其固体生成物中金属的化合价,先用非强氧化性的酸溶解,后用KSCN溶液检验铁离子的存在;
(4)①淡黄色固体可能为S或过氧化钠,甲+H2O→乙+丙,丙为气体,则乙为过氧化钠;
②Y为N元素,若丙为Y的氧化物,则Y为NO,甲为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,硝酸具有氧化性,氧化二氧化硫为硫酸根离子,自身被还原成一氧化氮.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,W为F元素,Z为O元素,Y为N元素,A为Cl元素,B为S元素.
(1)B为S元素,原子核外电子数为11,有3个电子层,最外层电子数为1,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)W为F元素,Z为O元素,为同周期元素,F的非金属性强于O,所以氢化物稳定性,HF>H2O,
故答案为:HF;
(3)生活中最常用的过渡金属单质为铁,在O2中点燃生成四氧化三铁,为确定其固体生成物中金属的化合价,先用非强氧化性的硫酸溶解,不能用硝酸,因硝酸具有强氧化性,能氧化亚铁离子,铁离子和KSCN络合显示血红色,所以用KSCN溶液检验铁离子的存在,
故答案为:AC;
(4)①淡黄色固体可能为S或过氧化钠,甲+H2O→乙+丙,硫和水不反应,2Na2O2+2H2O=4NaOH+O2↑,符合丙为气体,则乙为过氧化钠,
故答案为:Na2O2;
②Y为N元素,若丙为Y的氧化物,则Y为NO,甲为二氧化氮,二氧化氮和水反应3NO2+H2O=2HNO3+NO,生成的硝酸具有氧化性,氧化二氧化硫为硫酸根离子,自身被还原成一氧化氮,离子反应为:2H2O+3SO2+2NO3-=2NO+4H++3SO42-,
故答案为:2H2O+3SO2+2NO3-=2NO+4H++3SO42-.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 甲 | 乙 | |
| 所选试剂X | H2O2 | H2O2,少量稀H2SO4 |
| 操作 | 向5mLM和淀粉的混合溶液中加入1mL H2O2 | 向5mLM和淀粉的混合溶液中加入1mL H2O2,再加少量稀H2SO4 |
| 实验现象 | 几秒钟后,溶液呈现很淡的蓝色 | 溶液立刻呈现较深的蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 250 | 310 | 350 |
| K/(mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
| 浓度mol•L-1 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 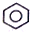 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$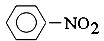 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com