
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第3周期ⅣA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为__、__,C、D的元素名称分别为__、__。
(2)写出B、C的常见单质在加热时的反应方程式:__。
(3)从原子结构的角度分析,A原子与B原子的__相同,C原子与D原子的__相同。
【答案】S O 钠 铝 2Na+O2![]() Na2O2 最外层电子数 电子层数
Na2O2 最外层电子数 电子层数
【解析】
根据元素在周期表中的位置及原子序数判断元素种类;根据物质性质书写反应方程式;根据原子结构分析解答。
(1)短周期是第1、2、3周期,由周期序数=电子层数、主族序数=最外层电子数、原子序数=核电荷数=核外电子数等,可推出A是硫,B是氧,C是钠。根据![]() 与
与![]() 的电子数相同,可得出D为铝,故答案为:S;O;钠;铝;
的电子数相同,可得出D为铝,故答案为:S;O;钠;铝;
(2)钠和氧气加热反应生成过氧化钠,反应方程式:2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2。
Na2O2。
(3)S和O都在VIA族,具有相同最外层电子数;钠和铝都是第3周期元素,具有相同电子层数,故答案为:最外层电子数;电子层数。


科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
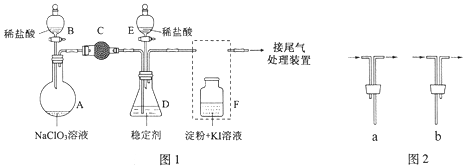
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:

(1)元素C的最高价氧化物的电子式为____;元素G的离子结构示意图为____。
(2)元素L位于周期表的第_________族,1mol/L LM2溶液500mL与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为___________。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乐山某高中化学兴趣小组同学用西红柿(或洋葱)作为供水剂,设计了如图装置验证铁与水蒸气的反应,并对产物进行检验。回答下列问题:
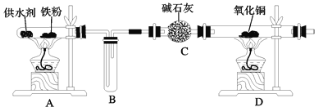
(1)A中铁与水蒸气反应的化学方程式是__。
(2)C中碱石灰的作用是__。
(3)D处实验现象为__。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:
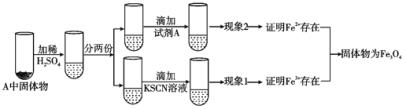
(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为__。
(Ⅱ)试剂A是__(选填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是_________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式________。
(3)A中固体分解后产生NH3,写出其两种用途_________。
(4)用实验的方法验证C溶液含有NH4+:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 的分子式均为C5H8O2,下列说法正确的是( )
的分子式均为C5H8O2,下列说法正确的是( )
A.x分子中碳原子均位于同一平面
B.x、y均能与NaOH溶液发生反应
C.y、z均能与![]() 反应生成
反应生成![]()
D.与它们互为同分异构体的链状羧酸有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
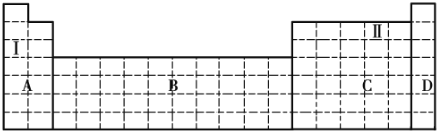
(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com