
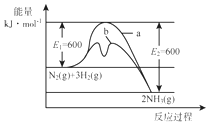
 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
分析 (1)根据图1计算出反应热,写出热化学方程式;催化剂能降低反应的活化能;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(3)依据化学平衡三段式列式计算,达到平衡状态,测得容器中NH3的体积分数$\frac{1}{9}$,设反应中转化的xmol氮气,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
根据v(N2)=$\frac{△c({N}_{2})}{t}$计算;根据k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$计算;
研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响,由控制变量法可知,②和④中只有温度不同,②和③中只有时间不同;
(4)N2与H2反应时,氮气得电子,原电池正极发生得电子的还原反应.
解答 解:(1)由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,所以b表示加入铁触媒的能量变化曲线;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1;b;
(2)A.该反应达到平衡状态时,2v(H2)正=3v(NH3)逆,故A错误;
B.单位时间内生成n mol N2的同时生成2n molNH3,分别表示正逆反应速率,而且正逆速率之比等于化学计量数之比,所以该反应达到平衡状态,故B正确;
C.无论该反应是否达到平衡状态,混合气体的密度始终不变,所以不能判断该反应是否达到平衡状态,故C错误;
D.该反应是一个反应前后气体体积减小的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故D正确;
E.断开一个氮氮键,表示正反应速率,形成3个氢氢键表示逆反应速率,而且正逆反应速率之比等于计量数比,所以反应达到平衡状态,故E正确;
F.参加反应的物质的浓度之比与反应物的初始浓度和转化率有关,所以C(N2):C(H2):C(NH3)=1:3:2,不一定达到平衡状态,故F错误;
故答案为:BDE;
(3)达到平衡状态,测得容器中NH3的体积分数$\frac{1}{9}$,设反应中转化的xmol氮气,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
则$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{9}$,解得x=0.2,
v(N2)=$\frac{△c({N}_{2})}{t}$=$\frac{\frac{0.2mol}{2L}}{0.5min}$=0.2mol/(L•min);
k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{(\frac{0.4mol}{2L})^{2}}{\frac{0.8mol}{2L}×(\frac{2.4mol}{2L})^{3}}$=$\frac{25}{432}$;
研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响,由控制变量法可知,
实验①和③,温度相同,反应时间相同,应研究反应物配比对氧化镁产率的影响,③中反应物配比应为4:1;
实验②和④,反应时间相同,反应物配比相同,温度不同,应是探究温度对产率的影响;
实验②和③,温度相同、反应物配比相同,反应时间不同,探究反应时间对产率的影响.
故答案为:0.2mol/(L•min);$\frac{25}{432}$;4:1;温度对产率的影响;③;
(4)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+.
点评 本题考查较为综合,涉及化学平衡的计算、化学平衡状态的判断、探究反应速率的影响因素、原电池等知识,题目难度中等,注意把握三段式在化学平衡计算中的应用方法,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:
某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
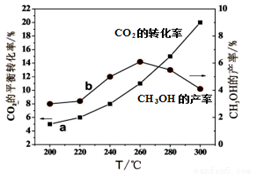 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
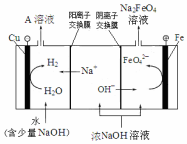 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com