
����Ŀ�������������±��Ԫ�صĵݱ��Է���������ƶϣ�������ȷ����( )
A����֪Ca�ǵ�4���ڡ��ڢ�A���Ԫ�أ���Ca(OH)2�ļ��Ա�Mg(OH)2�ļ�����
B����֪As�ǵ�4���ڡ��ڢ�A���Ԫ�أ���AsH3���ȶ��Ա�NH3���ȶ���ǿ
C����֪Cs��ԭ�Ӱ뾶��Na��ԭ�Ӱ뾶��Cs��ˮ��Ӧ����Na��ˮ��Ӧ����
D����֪Cl�ĺ˵������F�ĺ˵������Cl��ԭ�Ӱ뾶��F��ԭ�Ӱ뾶��
 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������A��Dͬ���壬C��Eͬ���壬D��E��Fͬ���ڣ�A��B������������֮����C��������������ȣ� A�ֱܷ���B��C�γɵ���������ȵķ��ӣ���A��C�γɵĻ����ﳣ����ΪҺ̬��A�ֱܷ���E��F�γɵ���������ȵ�������ӡ���ش��������⣨���е���ĸֻ����Ԫ�ش��ţ���ʵ��Ԫ�ط����أ���
��1��E��Ԫ�ط���Ϊ__________��E��F�����Ӱ뾶��С����____�������ӷ��ţ���
��2��A��C��D����Ԫ����ɵ�һ�ֳ�����������ȼҵ����Ҫ�IJ�Ʒ���û��������ʽΪ__________��
��3��B��C����⻯����ȶ�����ǿ����__________�������ʽ����
��4��B��F����Ԫ���γɵ�һ�ֻ�������ӣ���ԭ�Ӿ���8���ӽṹ����û����ﻯѧʽΪ___________��B��F����Ԫ�ػ����γ���һ�ֻ��������B��������ۣ��û���������ˮ��Ӧ���������ᣬ��д���û�������ˮ��Ӧ�Ļ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NA�ǰ����ӏ�����������˵����ȷ���ǣ� ��
A�� 7.lg����������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2NA
B�� V L amol/L���Ȼ�����Һ�У���Fe3+����ĿΪNA����Cl-����Ŀ����3NA
C�� ��״���£�22.4LNO��11.2LO2��Ϻ�����ķ�������Ϊ1.0NA
D�� ��ҵ�õ�ⷨ���д�ͭ����ʱ����ת��lmol���ӣ��������ܽ��ͭԭ������Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ǰ������������Ԫ���������±�:
���� | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Ԫ������ | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
�ɴ��Ʋ�ڰ����������ܺ��е�Ԫ��������( )��
A.18 B.32 C.50 D.64
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��Һ�������һ�����͵绯ѧ����װ��(��ͼ��ʾ)�����ҺΪ�廯пˮ��Һ�����ڵ���ʴ��͵�ؼ䲻��ѭ��������˵������ȷ����
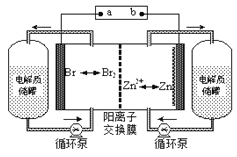
A.�ŵ�ʱ�����ĵ缫��ӦʽΪZn-2e-=Zn2+
B.���ʱ�缫aΪ��Դ�ĸ���
C.�����ӽ���Ĥ����ֹBr2��Znֱ�ӷ�����Ӧ
D. �ŵ�ʱ������ʴ����е�������Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ���λ�������ʾ��������˵����ȷ����
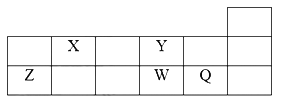
A. W���������Ӧ��ˮ����Ϊǿ��
B. ��Z��Y��ɵ�����������ʱ���ܵ���
C. W�õ���������Qǿ
D. X�ж���ͬ�������壬��Y������ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�۷ֱ���������ϡ���ᡢŨ���ᡢ�ȵ�Ũ���ᷴӦ���ռ�������������ͬ״����������ʱ������ͭ�۵�������Ϊ
A. 3:1:2 B. 3:2:2 C. 1:1:2 D. 1:3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.���Ӽ�ֻ�����ڽ��������������������֮��
B.���ַǽ���Ԫ���γ�AB�ͻ������һ�������ۼ�
C.�����л�ѧ���ƻ��ˣ�һ��������ѧ�仯
D.��ѧ������һ����Ԫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ8 gij�л���A(��Է�������Ϊ32)������������ȫȼ������������ֻ��11 g CO2��9 g H2O����A������ʽ�� ���仯ѧ��Ϊ ��д���������ڿ�����ȼ�յĻ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com