
【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
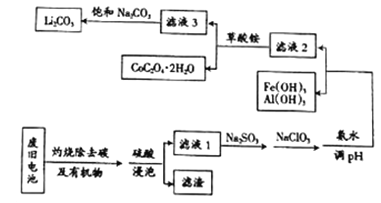
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
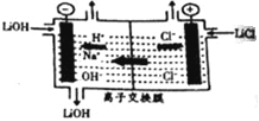
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。
【答案】+3 4H++CoO2=== 2H2O+Co3+ 将Co3+氧化为Co2+ 将Fe2+氧化为Fe3+ 4.5 Li2CO3溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失 2Cl--e-===Cl2↑ 2LiOH+2NH4HCO3===Li2CO3 + (NH4 )2CO3 + 2H2O
【解析】
(1)钴酸锂(LiCoO2)中锂的化合价为+1、氧为-2价,根据化合物化合价代数和为0可知,钴元素的化合价是+3价;(2)根据流程可知,废旧电池燃烧除去碳及有机物后利用硫酸浸泡得到的滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;故将CoO2-转化为Co3+的离子方程式为4H++CoO2=== 2H2O+Co3+;(3)滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;亚硫酸钠具有还原性,能将Co3+氧化为Co2+;NaClO3具有氧化性,能将浸出液中的Fe2+氧化为Fe3+;(4)依据已知的Ksp[Al(OH)3]=2.7×10-34,Ksp[Fe(OH)3]=1.0×10-39,可以求得Al3+和Fe3+完全以氢氧化物沉淀时(即金属离子浓度小于10-5mol·L-1时)的pH分别为:4.5和3.4;,加入氨水调节pH的最小值是4.5;(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是Li2CO3溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;(6)①电解LiCl溶液时阳极氯离子失电子产生氯气,电解反应式为2Cl--e-=Cl2↑;②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为2LiOH+2NH4HCO3===Li2CO3 + (NH4 )2CO3 + 2H2O。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
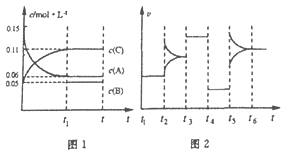
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700 -900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电极甲发生还原反应
B. 电池内的O2-由电极乙移向电极甲
C. 电池总反应为N2H4 +2O2= 2NO +2H2O
D. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4L O2参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是

A. 装置Ⅰ:先从①口进气收集满CO2,再从②口进气,可收集NO气体
B. 装置Ⅱ:可用该装置分离葡萄糖和淀粉的混合溶液
C. 装置Ⅲ:试管中盛有酸性高锰酸钾溶液可验证乙烯具有还原性
D. 装置Ⅳ:证明铁发生吸氧腐蚀时空气参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常教的值,N表示粒子数。下列叙述正确的是
A. 在标准状况下,78g苯的碳碳双键数目为3NA
B. 将1molCl2通入水中,则N(HClO)+N(C1-)+N(C1O-)=2NA
C. 将CO2通过Na2O2使其增重ag时,反应中转移电子数为aNA/44
D. 200g 30%的甲醛(HCHO)或醋酸溶液中含有的C原子总数都为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是___________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_________________________;
(4)该反应达到平衡时反应物X的转化率α等于__________________________________________ ;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是: 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关.下列叙述正确的是( )
A. 采用催化措施,将汽车尾气中的CO和NO转化为无害气体
B. 合金材料中不可能含有非金属元素
C. 信息产业中的光缆的主要成分是单质硅
D. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com