
| A. | 苯与溴水混合后振荡,水层褪色 | |
| B. | 乙烯通入酸性KMnO4溶液中,溶液褪色 | |
| C. | CH4与Cl2的混合气体光照后颜色变浅 | |
| D. | 乙烯通入溴水中,溴水褪色 |
分析 有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析.
解答 解:A、苯与溴水混合后不发生反应,但会发生萃取而使溴水层褪色,故A错误;
B、乙烯中含碳碳双键,能被高锰酸钾溶液氧化而使高锰酸钾被还原而褪色,故B错误;
C、甲烷和氯气混合后,甲烷中的氢原子会被氯原子取代,从而生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳,氯气被消耗,故颜色变浅,此为取代反应,故C正确;
D、乙烯中含碳碳双键,为不饱和键,和溴水反应时,双键断开,溴原子分别加到双键两端的碳原子上,为加成反应,故D错误.
故选C.
点评 本题考查了取代反应的判断,难度不大,明确取代反应的特征是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 常温常压下,18g水含有的分子数为 NA | |
| C. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA | |
| D. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中总压强不再随时间而变化 | |
| B. | v正(B)=0.03mol/(L•s),v逆(D)=1.2mol/(L•min) | |
| C. | 单位时间内断裂一个A-A键,同时生成两个C-C键 | |
| D. | 容器中混合气体的密度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是物理变化 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | NH3液化时放出大量的热,因此,氨常用作制冷剂 | |
| D. | 活性炭、SO2、Na2O2都能使品红溶液褪色,原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的原子结构示意图: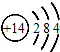 | |
| B. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 二氧化碳分子的电子式: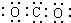 | |
| D. | 甲烷分子的比例模型: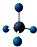 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
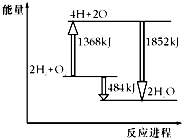 如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )
如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法不正确的是( )| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好完全反应生成正盐的溶液 | |
| B. | pH=7的溶液 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | c(H+)=c(OH-)=10-6mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
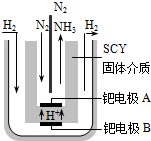 合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:
合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com