
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
分析 A.依据浓硫酸、浓硝酸中S、N的化合价判断;
B.浓硫酸具有吸水性、浓硝酸具有挥发性;
C.浓硫酸和浓硝酸均具有强氧化性,能够使铁、铝发生钝化;
D.铜与浓硫酸反应需要加热.
解答 解:A.浓硫酸、浓硝酸中S、N的化合价都处于最高价,反应中容易得到电子,具有强的氧化性,故A正确;
B.浓硫酸具有吸水性,能吸收空气中的水蒸气,浓硝酸具有挥发性,所以长期露置在空气中浓度均会降低,故B错误;
C.浓硫酸和浓硝酸均具有强氧化性,能够使铝发生钝化,形成致密氧化膜,所以可以用铝制容器贮存,故C错误;
D.铜与浓硫酸反应需要加热,常温下不反应,故D错误;
故选:A.
点评 本题考查了浓硫酸、浓硝酸的性质,根据浓硫酸和浓硝酸的强氧化性、与铝的钝化等知识点来分析解答即可,题目难度不大.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:解答题
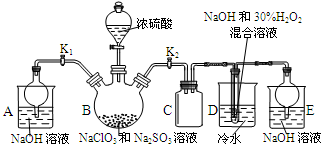 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、SO42-、K+ | B. | K+、OH-、CO32-、Na+ | ||
| C. | HCO3-、OH-、Cl-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水倒入浓硫酸中配制稀硫酸 | |
| B. | 金属钠着火,立即用泡沫灭火器灭火 | |
| C. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 | |
| D. | 皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LSO2含有的氧原子数均为1.5NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 23g Na在化学反应中失去的电子数目为NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
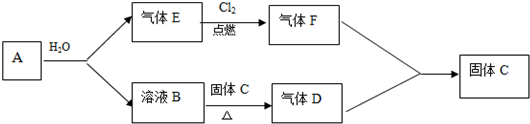
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com