
| A | B | C | D | |
| 甲 池 | HCl(aq) | CuCl2(aq) | NaOH(aq) | H2SO4(aq) |
| 乙 池 | NaCl(aq) | K2SO4(aq) | CuSO4(aq) | AgNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电解盐酸生成氢气和氯气,pH升高;电解氯化钠生成氢氧化钠和氯气、氢气,pH值升高;
B.电解氯化铜溶液,阴极电解反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑,铜离子浓度减小,水解生成的氢离子浓度减小,溶液的pH升高;电解硫酸钾实际是电解水,pH不变;阳极生成氧气,阴极生成氢气;
C.电解氢氧化钠,实质电解水,氢氧化钠溶液浓度增加;电极硫酸铜溶液生成硫酸、铜和氧气;
D.电解硫酸溶液,实质是电解水,pH下降,阴极电极反应为:2H++2e-=H2,阳极电极反应为:4OH--4e-=2H2O+O2↑;电解硝酸银溶液,溶液pH减小,阴极电解反应为:2Ag++2e-=2Ag,阳极电极反应为:4OH--4e-=2H2O+O2↑.
解答 解:A.电解盐酸、氯化钠溶液,pH值都升高,阳极产物都是氯气且物质的量相同,阴极产物都是氢气且物质的量也相同,故A正确;
B.电极氯化铜溶液,铜离子浓度减小,水解生成的氢离子浓度减小,pH值升高,电离硫酸钾实质电解水,溶液的pH值不变,故B错误;
C.电解氢氧化钠,实质电解水,氢氧化钠溶液浓度增加,pH值升高,电极硫酸铜溶液生成硫酸,溶液的pH值变小,故C错误;
D.甲池是电解硫酸溶液,实质是电解水,pH下降,阴极电极反应为:2H++2e-=H2,阳极电极反应为:4OH--4e-=2H2O+O2↑;乙池电解硝酸银溶液,溶液pH减小,阴极电解反应为:2Ag++2e-=2Ag,阳极电极反应为:4OH--4e-=2H2O+O2↑,pH变化趋势相同,但两阳极产物的物质的量不同,故D错误;
故选:A.
点评 本题考查了电解池类型及电解过程中溶液的变化,明确电解池工作原理和电极发生反应是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S=2HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

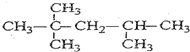 .
.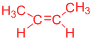 、
、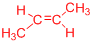 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 | |
| B. | 为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 | |
| C. | 检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 | |
| D. | 检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.0~60s,以X的浓度变化表示的反应速率为0.001mol·L-1·s-1
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com