
分析 (1)铁置换出Cu,Cu置换出Ag,氧化还原反应中还原剂的还原性大于还原产物的还原性,氧化剂的氧化性大于氧化产物分析;
有元素化合价变化的反应为氧化还原反应,含元素的化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂.
(2)①水作还原剂时,O元素的化合价升高;
②水既不作氧化剂又不作还原剂,则反应前后水中H、O元素的化合价不变;
(3)①HCl与氯化镁改写为离子形式,二氧化锰、氯气、水均写成化学式形式;
②二氧化锰是氧化剂,浓盐酸是还原剂;
③被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量;
④根据c=$\frac{1000ρω}{M}$计算该盐酸的物质的量浓度.
解答 解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+,氧化性最强的是Ag+;
故答案为:Fe;Ag+;
(2)A.2F2+2H2O═4HF+O2,O元素的化合价升高,是还原剂;
B.2Na+2H2O═2NaOH+H2↑氢元素的化合价降低是氧化剂;
C.CaO+H2O═Ca(OH)2 无元素化合价的变化;
D.2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,水既是氧化剂,也是还原剂;
故答案为:①A; ②C;
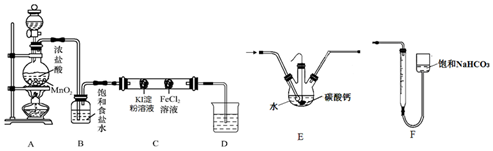
(3)①反应离子方程式为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②二氧化锰是氧化剂,浓盐酸是还原剂,故答案为:MnO2;Cl2;
③被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量为1mol×2=2mol,故答案为:2mol;
④根据c=$\frac{1000ρω}{M}$可知,浓盐酸质量分数为36.5%,密度为1.19g•cm-3,则该浓盐酸的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,故答案为:11.9mol/L.
点评 本题考查化学方程式计算、物质的量浓度计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.


科目:高中化学 来源: 题型:实验题
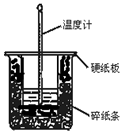 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
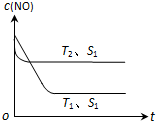 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
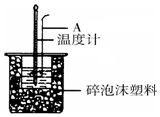 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
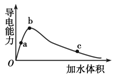 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com