
工业上氧化二氧化硫制三氧化硫反应的化学方程式为:
2SO2(g)+O2(g)  2SO3(g) ΔH=-198kJ·mol-1
2SO3(g) ΔH=-198kJ·mol-1
在一定条件下,将SO2和O2在体积不变的密闭容器中反应达到平衡状态,下列措施会使化学平衡向逆反应方向移动的是
A. 增加二氧化硫 B. 升高温度
C. 降低温度 D. 移出三氧化硫
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列有关化学用语表示不正确的是 ( )
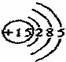 A.P原子的结构示意图:
A.P原子的结构示意图:
B.NaCl的电子式为: 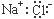
C.HCN分子的结构式:H—C≡N
D.含78个中子的碘的放射性核素: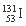
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
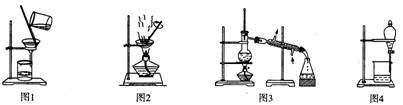
A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,
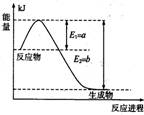
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为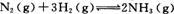 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
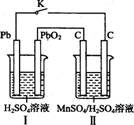
铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A(g)+B(g) = 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.vA=0.5mol·L-1·s-1
B.vB=0.3 mol·L-1·s-1
C.vC=0.8 mol·L-1·s-11
D.vD=1.0 mol·L-1·s-11
查看答案和解析>>
科目:高中化学 来源: 题型:
通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是
A.分子中键角小于109.5°是因为氮原子轨道杂化类型为sp2杂化
B.Cl的电负性强于N的电负性
C.NCl3分子是极性分子
D.NBr3 比NCl3 易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.苯酚沾在手上,应立即用NaOH溶液清洗
B.给试管中液体加热时,液体不超过试管容积的1/3
C.向NaOH溶液中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
D.试管壁上的银镜可用稀硫酸洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com