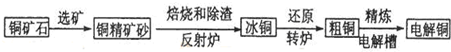
运用化学反应原理知识在工业生产中有重要意义.
(1)工业生产可以用NH
3(g)与CO
2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
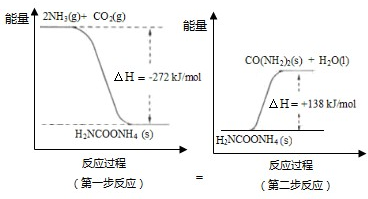
则NH
3(g)与CO
2(g)反应生成尿素的热化学方程式为
.
(2)工业生产中用CO可以合成甲醇
CO(g)+2H
2(g)?CH
3OH(g),△H=-90.1kJ?mol
-1在一定压强下,容积为V L的容器中充入a mol CO与2a mol H
2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
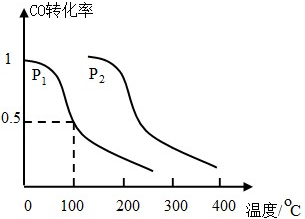
①p
1
p
2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=
(mol?L
-1)
-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH
2,达到新平衡时,CO的转化率
(填“增大”、“减小”或“不变”).
(3)工业生产中用SO
2为原料制取硫酸
①利用原电池原理,用SO
2、O
2和H
2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池的负极的电极反应式
.
②用Na
2SO
3溶液充分吸收SO
2得NaHSO
3溶液,然后电解该溶液可制得硫酸.电解原理示意图如下图所示.请写出开始时阳极反应的电极反应式
.
(4)工业生产中用氨水吸收SO
2若将等物质的量的SO
2与NH
3溶于水充分反应,写出该反应的离子方程式
,所得溶液呈
性.





 阅读快车系列答案
阅读快车系列答案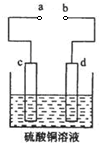 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: