
| A. | 实验室制备CO2的反应为:CaCO3+2HCl═CaCl2+H2O+CO2 | |
| B. | 向氯化铜溶液中滴加硝酸银溶液:Ag++Cl-═AgCl | |
| C. | 氢氧化钡和稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 稀硫酸滴到铜片上:Cu+2H+═Cu2++H2 |
分析 A.氯化氢和氯化钙为易溶的强电解质,应该拆开;
B.氯化铜与硝酸银溶液反应生成氯化银沉淀和硝酸铜;
C.氢离子、氢氧根离子的系数错误;
D.铜与稀硫酸不发生反应.
解答 解:A.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.向氯化铜溶液中滴加硝酸银溶液,反应的离子方程式为:Ag++Cl-═AgCl,故B正确;
C.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4+2H2O,故C错误;
D.铜活泼性较弱,不与稀硫酸反应,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 编号 | C(H2)mol/L | C(CO)mol/L |
| 甲 | 2 | 1 |
| 乙 | 1 | 2 |
| 丙 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
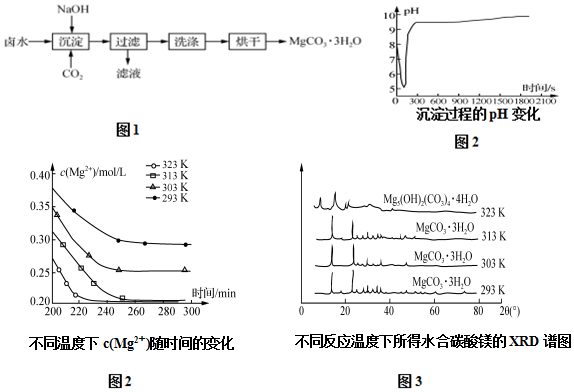
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用三氯化铝对自来水进行杀菌消毒 | |
| B. | 热的纯碱溶液可用于去油污 | |
| C. | 利用中和滴定原理可测定NaOH和NaCl混合液中NaCl的含量 | |
| D. | 用氯化铵浓溶液可除去铁器表面的铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(苯) | |
| B. | MgCl2酸性溶液中少量的FeCl3(Mg(OH)2) | |
| C. | 硝基苯中的苯(硝酸) | |
| D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com