(2011?顺义区二模)甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
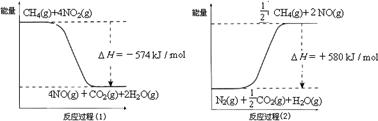
反应过程(2)是
吸热
吸热
反应(填“放热”或“吸热”),甲烷还原NO
2生成H
2O(g)、N
2和CO
2时的热化学方程式是
2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
.
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl
4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl
4(g)+H
2(g)?CHCl
3(g)+HCl(g),使CCl
4转化为重要的化工原料氯仿(CHCl
3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验
序号 |
温度℃ |
初始n(CCl4)
(mol) |
初始n(H2)
(mol) |
平衡时n(CHCl3)
(mol) |
| 1 |
110 |
0.8 |
1.2 |
|
| 2 |
110 |
2 |
2 |
1 |
| 3 |
100 |
1 |
1 |
0.6 |
①此反应在110℃时平衡常数为
1
1
. ②实验l中,CCl
4的转化率为
60%
60%
.
③判断该反应的正反应是
放热
放热
(填“放热”或“吸热”),理由是
温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
.
④为提高实验3中CCl
4的转化率,可采取的措施是
e
e
.
a.使用高效催化剂 b.向容器中再投入1mol CCl
4和1mol H
2c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H
2.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案