
��7�֣�
��1������Zn��2FeCl3=ZnCl2��2FeCl2��Ӧ�����һ��ԭ��أ�д���缫��Ӧʽ�� ���� ������ ���������Һ ���缫��Ӧʽ �� ��
��2�����в�������ʹ�����Ƶ�NaOH��ҺŨ��ƫ�ߵ���
A �������dz��ڱ�¶�ڿ����е�NaOH
B ����ƿ������
C ���ܽ����ձ��е�NaOH��Һδ����ȴ��ת�Ƶ�����ƿ�н������ơ�
D ��������ƿ����Һ����Һ����ڿ̶��ߣ���������ƿ�м�����ˮ���̶���
E������ʱ������Һ��ʹ֮��̶�������
(1)������C��Cu��������Zn ���������Һ��FeCl3��Һ����ÿ��1�֣�
������Ӧʽ��Zn��2e����Zn2����������Ӧʽ��2Fe3����2e����2Fe3����ÿ��1�֣�
(2) ��2�֣�CE
���������������1���ɷ�ӦZn+2FeCl3�TZnCl2+2FeCl2��֪����Ӧ��пʧ���ӱ�������ӦΪԭ��ظ������缫��ӦΪZn-2e-=Zn2+������ӦΪ�����Ա�Zn���Ľ�����ǽ������ϣ�Fe3+�������õ����Ӷ�����ԭ���缫��ӦʽΪFe3++e-=Fe2+���������ҺΪFeCl3����2��A�����������׳��⣬�������ڱ�¶�ڿ����е�NaOH��������ʵ���ƫС��������Һ��Ũ��ƫ�ͣ�����B������ƿ����������ƽ����Ӱ�죬����C�����ܽ����ձ��е�NaOH��Һδ����ȴ��ת�Ƶ�����ƿ�н������ƣ���ȴ�����º�������Һ�����ƫС��������Һ�����ƫ�ߣ���ȷ��D����������ƿ����Һ����Һ����ڿ̶��ߣ���������ƿ�м�����ˮ���̶��ߣ�������Һ�����ƫ��Ũ��ƫ�ͣ�����E������ʱ������Һ��ʹ֮��̶������У�������Һ�����ƫС��Ũ��ƫ�ߣ���ȷ��ѡCE��
���㣺����ԭ���ԭ������Һ������������


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��NA��ʾ�����ӵ�������ֵ������������ȷ����
| A�������£�1L 0.1mol/L��NH4NO3��Һ�е�ԭ����Ϊ0.2NA |
| B�����³�ѹ�£�22.4L CH4����4NA��C��H���ۼ� |
| C��2mol N2��2mol H2��ϳ�ַ�Ӧ��ת�Ƶĵ�����ĿΪ4NA |
| D��10L pH=1��������Һ�к��е�H+������Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и��������з�������ͬ���ǣ� ��
| A��2LCO��2LCO2 |
| B��9gH2O�ͱ�״����11.2LCO2 |
| C����״����1molO2��22.4LH2O |
| D��0.2molH2��4.48LHCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����йػ�ѧ����ʹ����ȷ����(�� ��)
A��CO2�ĵ���ʽ�� |
B��������8�����ӵ�̼ԭ�ӣ�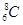 |
C����ԭ�ӽṹʾ��ͼ�� |
D����ϩ�ı���ģ�ͣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ������Ҫ0��1 mol��L NaOH��Һ450 mL��0��5mol��L������Һ480 mL��������������Һ����������ش��������⣺
(1)��ͼ��ʾ��������������Һ��Ҫ���� (���ֺ�)������������Һ�����õ��IJ��������� (����������)��
(2)���в����У�������ƿ���߱��Ĺ����� ��
A������һ�����ȷŨ�ȵı���Һ B��������Һ
C����������Ũ�Ⱥ�����ı���Һ D��ϡ��ijһŨ�ȵ���Һ E����ȡһ�������Һ��
(3)���ݼ�����������ƽ��ȡNaOH������Ϊ g����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ�� (����ڡ������ڡ���С�ڡ�)0��1 mol��L����NaOH��Һ��ת��������ƿʱ������������������Ҫ��β����� ��
(4)���ݼ����֪��������������Ϊ98�����ܶ�Ϊl.84 g��cm3��Ũ��������Ϊ ml�����ʵ������10 mL��15 mL��20 mL��Ͳ��Ӧѡ�� mL����Ͳ��á����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ���������� ��
(5)���в�����ʹ���Ƶ�NaOH��ҺŨ��ƫ�� ���ǡ�
A������ֽ����NaOH B��ѡ�õ�����ƿ������������ˮ
C������ҡ�Ⱥ�Һ���½����ּ�ˮ���̶��� D���������ƹ����У�����ƿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10�֣���Ҫ��ش����⣺
��1�������ữ�ĸ��������Һ����ᷴӦ���ӷ���ʽ
��2����������������ᷴӦ�Ļ�ѧ����ʽ
��ҵ��������Ȼ������Ҫ�ɷ�ΪCH4����CO2���и��������Ʊ�CO����֪CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ?890��3kJ?mol?1��?285�� 8 kJ?mol?1��?283��0 kJ?mol?1��������1m3����״����CO��������Ϊ
kJ
�� ��д���������ʵ���ʽ
CO2 H2O2 NH4Cl N2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(4�֣�ȡ14��3g Na2CO3?XH2O ����ˮ���100m L ��Һ��Ȼ����ε���ϡ����ֱ��û������ų�Ϊֹ����ȥ���� 20��0m L�����ռ���1��12 L CO2����״�������Լ��㣺
��1��ϡ�������ʵ���Ũ��Ϊ mol/L��
��2��xֵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2(���н϶��MnO��MnCO3)��Ʒת��Ϊ��MnO2��ʵ�飬���������£�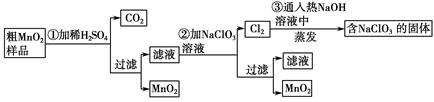
(1)�ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� (д��ѧʽ)ת��Ϊ���������ʡ�
(2)�ڢڲ���Ӧ�����ӷ���ʽ�� ��
�� ClO3����
ClO3���� =
= MnO2����
MnO2���� Cl2����
Cl2���� ��
��
(3)�ڢ۲������������������������̨(����Ȧ)�� �� �� ����֪�����õ��Ĺ�������NaClO3��NaOH����һ�������� (д��ѧʽ)��
(4)����MnO2��Ʒ������Ϊ12.69 g���ڢٲ���Ӧ�����˵õ�8.7 g MnO2�����ռ���0.224 L CO2(��״����)�����ڵڢڲ���Ӧ��������Ҫ mol NaClO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ȼ�����һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㡣��ҵ�Ͽɽ���м���������У�������FeCl2����ͨ��Cl2�������Ʊ�FeCl3��Һ��
(1)����״���µ�a L�Ȼ�����������100 gˮ�У��õ���������ܶ�Ϊ
b g��mL��1�������������ʵ�����Ũ����________��
��100 mL��FeBr2��Һ��ͨ���״����Cl2 3.36 L����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ ________��
(3)FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ____________________ _____________________(�����ӷ���ʽ��ʾ)����100mL 2mol��L��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����________0.2NA(����ڡ��������ڡ���С�ڡ�)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com