
| 实验序号 | A 溶液 | B 溶液 |
| ① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1KMnO4 酸性溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4酸性溶液 |

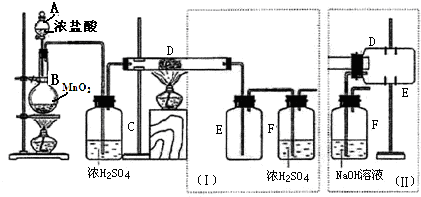
分析 (1)关闭分液漏斗的活塞,拉动活塞,松手后观察活塞是否复原可检查气密性;
(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平方程式;
(3)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
(4)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;
(5)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.
解答 解:(1)检验装置气密性的简便方法为先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好,
故答案为:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好;
(2)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4比例关系为2:5,根据电荷守恒配平方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;
(3)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大,
故答案为:浓度;②>①;
(4)CO2的物质的量为:$\frac{4.48×1{0}^{-3}L}{22.4L/mol}$=0.0002mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol•L-1-0.00004mol=0.00026mol
c(MnO4-)=$\frac{n}{V}$=$\frac{0.00026mol}{0.05L}$=0.0052mol/L;
故答案为:0.0052;
(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+是反应的催化剂,
故答案为:该反应放热;产物Mn2+是反应的催化剂.
点评 本题考查了影响化学反应速率的因素,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法,难度中等.


科目:高中化学 来源: 题型:实验题
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| ①溶液的酸性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴3.0mol•L-1HNO3. | 现象:棕黄色溶液颜色变浅; 结论:酸性增强抑制Fe3+水解. |
| ②溶液的浓度 | 取10mL0.5mol•L-1 Fe(NO3)3于烧杯中,用pH计测得pH1.另取90mL蒸馏水加入烧杯,充分搅拌,再测得pH2. | 现象:pH2-pH1<1(或正确表达) 结论:稀释促进水解(或平衡右移) |
| ③溶液的温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,用酒精灯加热一段时间,观察溶液颜色 | 现象:加热后溶液颜色变深 结论:升高温度促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应均为吸热反应 | |
| B. | lmol 酸与lmol 碱恰好中和时所放出的热量叫中和热 | |
| C. | 若S ( s )+O2 (g)=SO2(g)△H1,S(g)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| D. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15.5 g•mol-1 | B. | 85 g•mol-1 | C. | 55 | D. | 55 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 光照氯水有气泡冒出,该气体主要为Cl2 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | Na[Al(OH)4]溶液和盐酸可以通过相互滴加的方法来鉴别,NaHCO3溶液和Ca(OH)2溶液也可以通过相互滴加的方法来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量是40g | |
| B. | 1mol氢氧根离子的质量是17g | |
| C. | 1mol氮的质量是14g/mol | |
| D. | 氩气的摩尔质量就是它的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 常温常压下,46 g NO2和N2O4的混合气体中含有的氧原子数为2NA | |
| C. | 1mol/L的Ba(NO3)2溶液中含NO3-离子数为2NA | |
| D. | 分子数为NA的CO和N2的混合气体的体积约为22.4 L,质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的摩尔质量等于它的相对原子质量 | |
| B. | CH4的摩尔质量为16 g/mol | |
| C. | 22.4 L任何气体的物质的量均为1 mol | |
| D. | 1 mol 任何物质均含有NA个分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com