
| A、Na+、H+、SO42-、I- |
| B、K+、SO42-、Cl-、CO32- |
| C、Na+、Fe2+、H+、Cl- |
| D、Na+、K+、Al3+、CO32- |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当d极消耗2g H2 时,a极周围会产生22.4L H2 |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、c极上发生的电极反应是:O2+2H2O+4e-=4OH- |
| D、c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| B、元素X和Q形成的化合物中不可能含有共价键 |
| C、X、Z、M的单质分别与水反应,Y最剧烈 |
| D、Y的氢化物的水溶液可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以Y浓度变化表示的反应速率为0.0005mol/(L?s) | ||
B、其他条件不变,将容器体积扩大至20L,则Z的平衡浓度变为原来的
| ||
| C、其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 | ||
| D、其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解,假设在电解过程中产生的气体全部逸出.下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解,假设在电解过程中产生的气体全部逸出.下列说法正确的是( )| A、甲烧杯中溶液的pH不变 |
| B、乙烧杯中c电极的反应式为:4OH--4e-?2H2O+02↑ |
| C、当b极增重21.6g时,d极产生的气体在标准状况下为2.24L |
| D、当电解足够时间后,将甲、乙两烧杯中的溶液混合,一定会有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
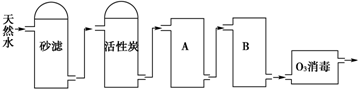
查看答案和解析>>
科目:高中化学 来源: 题型:

| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com