
 ��1��ʵ��֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ��ʵ���п�����Ƴ�ԭ��ص���
��1��ʵ��֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ��ʵ���п�����Ƴ�ԭ��ص���
| ||
| ||


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AgNO3��Һ |
| B��HCl��Һ |
| C��NaCl��Һ |
| D��ϡNaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
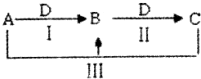 A��B��C��D������ѧ��ѧ�г������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ���£����ַ�Ӧ�е�ˮ����ȥ������������ش��������⣺
A��B��C��D������ѧ��ѧ�г������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ���£����ַ�Ӧ�е�ˮ����ȥ������������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
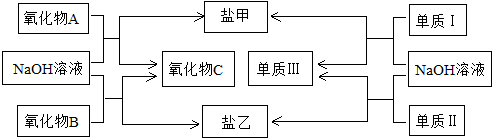
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ���� | 414 | 489 | 565 | 158 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/Lϡ�����к�����������Ӹ���Ϊ0.1NA |
| B��32g O2��O3��������к���ԭ����Ϊ2NA |
| C��1mol Mg������N2��Ӧ����Mg3N2ʧȥ�ĵ�����Ϊ2NA |
| D��1mol H2��O2�Ļ�������ڱ�״���µ����ԼΪ22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ʳƷ���Ӽ���ʳ������彡�����к�������ʳ�� |
| B��Ϊ��ֹ����е��ؽ�����������Ⱦ������ˮ�壬Ӧ���������ϵ�صĻ������ü��� |
| C����������������ĺϽ���þ���Ͻ� |
| D����ҵ����H2��ԭMgCl2�ķ�����ȡ����þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��18g | B��24g |
| C��30g | D��36g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com