
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
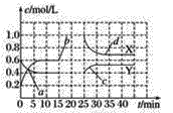
A.前10 min内用NO2表示的化学反应速率v(NO2)=0.02 mol·L-1min-1
B.反应进行至25 min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
【答案】A
【解析】
根据题中2NO2(g)N2O4(g)可知,本题考查化学反应速率和化学平衡,运用化学反应速率计算公式和勒夏特列原理分析。
由图可知0﹣10 min平衡状态时,X曲线Δc=(0.6﹣0.2)mol·L-1=0.4 mol·L-1,Y曲线Δc=(0.6﹣0.4)mol·L-1=0.2 mol·L-1,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10 min内用NO2表示的化学反应速率v(NO2)=![]() =
=![]() =0.04 mol·L-1min-1,故A错误;
=0.04 mol·L-1min-1,故A错误;
B.反应进行至25 min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),故B正确;
C.若要达到与最后相同的化学平衡状态,在25 min时还可以增大生成物平衡逆向移动来实现,故C正确;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,b、d点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半
B.5.6g铁与足量稀硫酸反应失去的电子的物质的量为0.2mol
C.标准状况下,11.2LNO2气体中含氧原子数大于18g水中含有的氧原子数
D.20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发一种低成本的铝硫二次电池,以铝箔和多孔碳包裹的S为电极材料,离子液体为电解液。放电时,电池反应为2Al+3S=Al2S3,电极表面发生的变化如图所示。下列说法错误的是( )
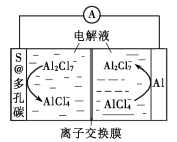
A.充电时,多孔碳电极连接电源的负极
B.充电时,阴极反应为8Al2Cl7-+6e-=2Al+14AlCl4-
C.放电时,溶液中离子的总数不变
D.放电时,正极增重0.54g,电路中通过0.06mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池在生活巾应用广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
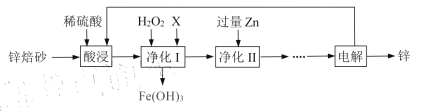
回答以下问题:
(1)ZnFe2O4中Fe的化合价是_______。
(2)为了提高酸浸效率,可采用的措施是_______(至少两条)。
(3)净化I的过程中温度不能太高,原因是________。
(4)X可以调节pH,则X为________。
(5)净化II中的离子反应方程式_______.
(6)本流程中可以循环利用的物质除锌外还有________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(g)+Y(g) ![]() 2Z(g)△H<0。一定条件下,反应物Y的转化率与反应时间的关系如图所示。若使曲线a变为曲线b可采取的措施是
2Z(g)△H<0。一定条件下,反应物Y的转化率与反应时间的关系如图所示。若使曲线a变为曲线b可采取的措施是
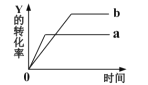
A.加入催化剂B.降低温度C.增大压强D.增大Y的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气的反应为C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
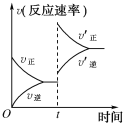
A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
实验一:测定硫元素的含量
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体。
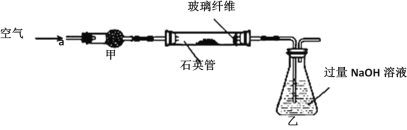
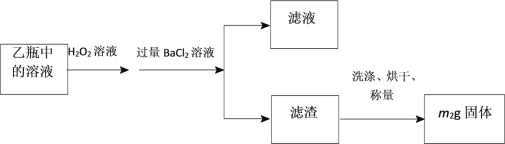
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题与讨论:
(1)石英管中发生反应的化学方程式为_________。
(2)I中,干燥管甲内所盛试剂是________,石英管中的玻璃纤维的作用为__________。
(3)该黄铁矿石中硫元素的质量分数为___________。
实验二:测定铁元素的含量

问题与讨论:
(4)步骤②中,若选用铁粉作还原剂,会使测量结果________(填“不影响”、“偏高”或“偏低”)。
(5)步骤③中,需要用到的玻璃仪器有烧杯、玻璃棒、_______、________。
(6)滴定终点的现象是___。
(7)用c mol/LKMnO4溶液滴定,终点时消耗KMnO4溶液V mL,则黄铁矿中铁元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的性质是了解工农业生产的重要基础。NA为阿伏伽德罗常数的值,下列有关说法错误的是
A.22.4 L(标准状况)15NH3含有的质子数为10 NA
B.密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2 NA
C.13.8 g NO2与足量水反应,转移的电子数为0.2 NA
D.常温下,1 L 0.1 mol·L1 NH4NO3溶液中含有的氮原子数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com