
在含有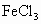 和
和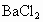 的酸性溶液中,通入足量的
的酸性溶液中,通入足量的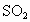 气体,有白色沉淀产生,过滤后向滤液中滴加KSCN溶液未见血红色,由此得出的结论是
气体,有白色沉淀产生,过滤后向滤液中滴加KSCN溶液未见血红色,由此得出的结论是
[ ]
A.白色沉淀是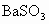
B.白色沉淀是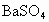
C.白色沉淀是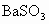 和S的混合物
和S的混合物
D.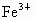 被
被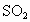 还原为
还原为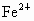
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:021
在含有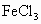 和
和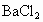 的酸性溶液中,通入足量的
的酸性溶液中,通入足量的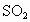 气体,有白色沉淀产生,过滤后向滤液中滴加KSCN溶液未见血红色,由此得出的结论是
气体,有白色沉淀产生,过滤后向滤液中滴加KSCN溶液未见血红色,由此得出的结论是
[ ]
A.白色沉淀是
B.白色沉淀是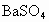
C.白色沉淀是 和S的混合物
和S的混合物
D.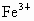 被
被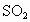 还原为
还原为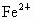
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的电离程度相同
B.在含有Al3+的KNO3溶液中,可通过加热的方法除去Al3+,证明盐的水解是吸热反应
C.已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等
D.等物质的量浓度的 ① NH4Cl ② NH4HSO4 ③ Na2S ④ NaNO3 ⑤ (NH4)2SO4 ,
其pH由大到小的排列为③>④>⑤>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com