
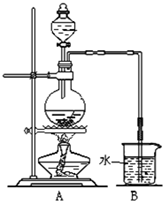
(5分)如图是某同学设计的放热反应的观察装置。
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:
(1)实验中观察到的现象是 。
(2)该实验中在安装好装置后必须进行的第一步实验操作是 。
(3)实验中反应的化学反应方程式是 。
(4)说明CaO、H2O的能量之和 Ca(OH)2的能量。(填“>”、“<”或“=”)
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象? 。
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
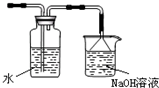
 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
| ||
| ||
 )
) )
)查看答案和解析>>
科目:高中化学 来源: 题型:
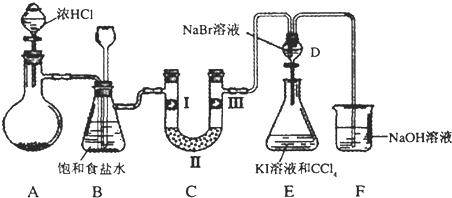
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源:贵州省凯里一中2009届第二轮限时训练理综化学(4) 题型:058
如图是某化学兴趣小组的同学设计的制取NH3并进行NH3性质实验的改进装置.他们先称取mg固体氯化铵放入试管底部,再快速称取ng氢氧化钠固体盖在氯化铵表面,立即用带滴管的胶塞塞紧试管(滴管内事先吸入一定体积的浓氨水),慢慢挤压胶头滴管,立即看到试管内产生大量气泡.请回答有关问题:
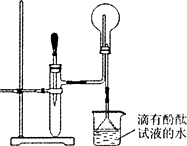
(1)该化学兴趣小组的同学对用此装置制取NH3的原理进行了分析,你认为合理的是(填序号):________;
①浓氨水中存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH+4+OH-,NaOH使平衡向左移动;
NH+4+OH-,NaOH使平衡向左移动;
②浓氨水中存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH+4+OH-,NH4Cl使平衡向左移动;
NH+4+OH-,NH4Cl使平衡向左移动;
③NaOH溶于水时放热,温度升高,NH3的溶解度减小,有部分NH3逸出;
④NH4Cl和NaOH在此条件下反应,生成NH3.
(2)简述判断图中烧瓶内收满NH3的现象:________;
(3)该实验还能证明NH3的什么性质?________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com