
下列说法不正确的是
A.(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出
B.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为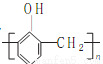
C.醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物
D.迷迭香酸的结构为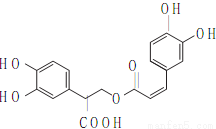 它可以发生酯化、水解但不能加成反应
它可以发生酯化、水解但不能加成反应
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:实验题
雾霾含有大量的污染物SO2、NO。工业上变废为宝利用工业尾气获得NH4NO3产品的流程图如下:(Ce为铈元素)
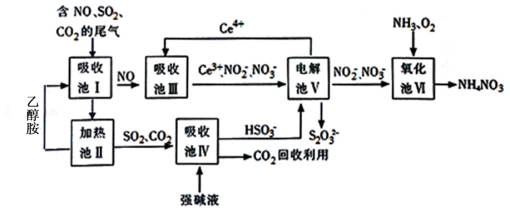
(1)上述流程中循环使用的物质有 。
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O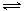 HOCH2CH2NH3+ +OH-,写出乙醇胺吸收CO2的化学方程式 。(3)写出吸收池Ⅲ中酸性条件下NO转化为NO2-(或NO转化为NO3-)的离子方程式: (任选其一)。
HOCH2CH2NH3+ +OH-,写出乙醇胺吸收CO2的化学方程式 。(3)写出吸收池Ⅲ中酸性条件下NO转化为NO2-(或NO转化为NO3-)的离子方程式: (任选其一)。
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: 。
(5)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是 、 、过滤、洗涤等。上述流程中每一步均恰好完全反应,若制得NH4NO3质量为0.8kg,电解池V制得2mol/L的S2O32﹣溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是

A.X、W、Z元素的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2和WX3均属于离子化合物
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列有关物质性质的比较中,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.原子半径:S>O>F D.热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:简答题
生活用水的净化、消毒杀菌处理与生产、生活废水的无害化处理与我们的生活密切相关,回答下列问题。
(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是___________水,除去水垢中CaSO4的试剂是纯碱、盐酸,写出除去CaSO4的离子反应方程式______________________、______________________。
(2)K2FeO4是一种新型的水处理剂,它兼有消毒杀菌、净水双重功能,具有消毒杀菌功能是因为它有___________性。但若水的酸性或碱性较强,该试剂的净水功能均会减弱甚至消失,原因是____________________________________________。
(3)右图是离子交换柱结构示意图,则左侧的是___________(填阴或阳)离子交换柱。硬度为1毅的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)的水。若某天然水中其它离子转化后相当于有c(Ca2+)=1.0×10-3mol/L,此水是否符合我国饮用水的硬度标准为___________(生活用水卫生标准规定,总硬度不超过450mg/L,写出计算式)。
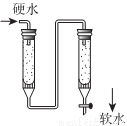
(4)用双硫腙(H2Dz)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Hg(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
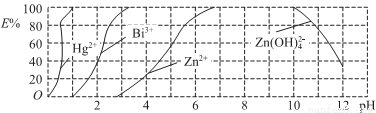
①当废水的pH=4时,废水中能以简单金属离子形式存在的离子是___________。
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,废水的pH=___________。
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
1mol某烃A充分燃烧后可以得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化.

已知:①CH3—CH=CH2→+HBrCH3—CHBr—CH3
于CH3CH2Br+NaOH CH3CH2OH+NaBr
CH3CH2OH+NaBr
③CH3CH2Br+NaOH CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
(1)A的化学式:___________。
(2)上述①~⑥反应中属于消去反应是___________(填序号)。
(3)写出C、D、E、物质的结构简式:C___________,D___________,E___________。
(4)写出B→E反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
B.向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO
D.单质钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:选择题
下列表述正确的是
A.二氧化硫、氨、煤的液化均为物理变化
B.2CH3CH2OD+O2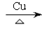 2CH3CHO+2DHO
2CH3CHO+2DHO
C.甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低
D.已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中: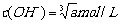
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期主族元素,原子半径依次减小。E元素与其它元素不在同一周期。C、D在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。A、B同周期,A2B是离子化合物。请回答:
(1)A2B的名称为 。C与E形成的具有10电子的4核分子的结构式为 。
(2)由上述五种元素中的某几种元素所形成的具有漂白作用的物质的化学式是:_______________(任意写一种)。
(3)B的最高价氧化物的水化物的浓溶液有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为 。
(4)由以上五种元素两两组合所形成的化合物中,有些物质能与水反应生成气体且属于氧化还原反应,请写出其中一个反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com