
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H1=﹣443.64kJmol﹣1
2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol﹣1
下列说法或热化学方程式正确的是( )
A.CO的燃烧热为566.0kJmol﹣1
B.2molCO和1molO2的总能量比2molCO2的总能量低
C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1453.28kJmol﹣1
【答案】D
【解析】
A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ·mol-1,则CO的燃烧热为283.0 kJ·mol-1,故A错误;
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ·mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ·mol-1,根据盖斯定律①+②×![]() 得CH3OH(l)+
得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ·mol-1 ,则完全燃烧20g甲醇,即0.625mol,则放出的热量为0.625mol×726.64kJ·mol-1 =454.15 kJ,故C错误;
O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ·mol-1 ,则完全燃烧20g甲醇,即0.625mol,则放出的热量为0.625mol×726.64kJ·mol-1 =454.15 kJ,故C错误;
D.由C项知CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ·mol-1 ,方程式的计量数加倍,则反应热也加倍,则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ·mol-1,故D正确;
O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ·mol-1 ,方程式的计量数加倍,则反应热也加倍,则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ·mol-1,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
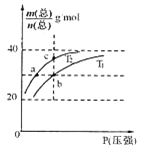
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
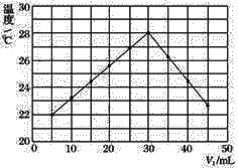
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:Pb+PbO2+2H2SO4= 2PbSO4+2H2O,下列有关说法正确的是
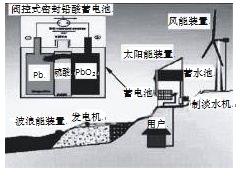
A.图中涉及的能量转化方式只有3种
B.该发电工艺可实现零排放
C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+
D.储能时若充电时间过长,阳极流向阴极的气体可能是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名导演陈晓卿执导的纪录片《风味人间》中第一集中介绍了一种川西地区的民间美食-灰水煮笋,这里的“灰水”即指加了草木灰的水。草木灰中富含K2CO3(还有少量的KCl和K2SO4),某兴趣小组打算从“灰水”中提取KCl,请你帮他们完成以下工作。
(1)检验“灰水”溶液中的SO42______________________________________________________________________。
(2)检验“灰水”溶液中的CO32。
①小组内有同学认为,往上层澄清溶液中滴入Ca(OH)2溶液观察白色沉淀产生即可证明其中含有CO32。你认为此方案是否正确?__________(填“正确”或“错误”),理由是__________________________________________________________。
②小组内另一同学认为,应往澄清溶液中加入过量稀盐酸,通过______的现象判断CO32-的存在。写出加入过量盐酸反应的离子方程式__________________________。
(3)经过充分讨论后,小组内同学共同设计出了下面的分离提纯路线:

①“混合物1”经过一系列操作最终得到KCl固体,下列操作顺序合理的是______。
a、加入过量K2CO3溶液 B、加入过量稀盐酸 C、过滤 D、蒸发结晶
A、a→b→c→d B、a→c→b→d
C、b→c→a→d D、c→a→b→d
②实验室中,蒸发结晶操作应在___________(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe2+、Al3+、NH4+、Cl、CO32 和SO42。现每次取100.00mL进行实验:(已知:NH4++OH - ![]() NH3↑ +H2O)
NH3↑ +H2O)
① 第一份加入AgNO3溶液有沉淀产生;
② 第二份加入足量NaOH后加热,收集到气体0.896 L(标准状况下)
③ 第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。请回答:
(1)c(CO32) =_________mol/L;
(2)K+ 是否存在?__________;若存在,浓度范围是__________(若不存在,则不必回答第2问);
(3)根据以上实验,不能判断______(填离子符号)是否存在。若存在此离子,如何进行检验?_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Z在元素周期表中的位置是_________________________。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_______________________。
(3)单质铜和元素M的最高价氧化物对应水化物的浓溶液发生反应的离子方程式为___________________。
(4)元素X的金属性比元素Y______(填“强”或“弱”)。
(5)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中选择的仪器正确的是:①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中到蒸馏水③分离氯化钾和二氧化锰混合物 ④从氯化钠溶液中得到氯化钠晶体

A. ①-丁 ②-丙 ③-甲 ④-乙 B. ①-乙 ②-丙 ③-甲 ④-丁
C. ①-丁 ②-丙 ③-乙 ④-甲 D. ①-丙 ②-乙 ③-丁 ④-甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为空间网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com