
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | H2、SO2、CO2三种气体都可用浓H2SO4干燥 | |
| C. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
分析 A.NaHCO3不稳定,加热易分解;
B.浓硫酸具有酸性、强氧化性、吸水性和脱水性,所以浓硫酸不能干燥还原性气体、碱性气体;
C.氢氧化铁胶体为红褐色;
D.二氧化硅是酸性氧化物,酸性氧化物可以与碱反应生成盐和水.
解答 解:A.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,加热不分解,故A错误;
B.H2、SO2、CO2三种气体均不与浓硫酸反应,故能利用浓硫酸干燥,故B正确;
C.Fe(OH)3胶体为红褐色、透明,不是无色,故C错误;
D.二氧化硅是酸性氧化物,酸性氧化物可以与碱反应生成盐和水,因此二氧化硅能与氢氧化钠溶液反应,但和氢氟酸反应是二氧化硅的特性,故D错误,
故选B.
点评 本题考查化学实验方案的评价,涉及物质性质的分析应用,熟练掌握浓硫酸、二氧化硅的性质、常见胶体的颜色与性质等基础知识是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L | |
| B. | 5.6g铁与足量的氯气反应,转移电子数为0.2NA | |
| C. | 11.2LH2O所含有的原子数为1.5NA | |
| D. | 0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
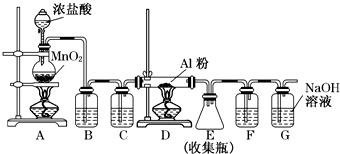
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.8 mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g) 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
A .新平衡体系中,SO2和O2物质的量之比仍为2∶1
B .平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C .新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D .若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Mg | |
| B. | 电池放电时,负极反应为Mg+2OH--2e-═Mg(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com