
可逆反应2NO2 2NO + O2在体积不变的密闭容器中反应,现有以下几种
说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示达到平衡状态的表述是( )
A.①④ B.②④⑥ C.①②③ D.①②④⑤
科目:高中化学 来源: 题型:
 N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:查看答案和解析>>
科目:高中化学 来源: 题型:
 Al(OH)3+3HCl
Al(OH)3+3HCl Al(OH)3+3HCl
Al(OH)3+3HCl
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
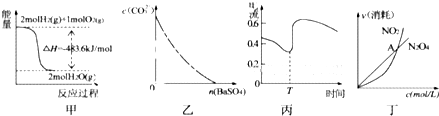
| A、图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 | B、图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 | C、图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 | D、图丁表示恒温恒容条件下发生的可逆反应2NO2?N202(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com