
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某化合物在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
分析 A、MgF2晶体中的化学键是离子键;
B、金属在熔融态能导电,而化合物在熔融态能导电,则该化合物一定是离子化合物,其中一定含有离子键;
C、N2分子中是氮氮叁键,而Cl2分子中氯氯单键,所以每个原子的最外层都具有8电子稳定结构;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成.
解答 解:A、MgF2晶体中的化学键是离子键,而不是共价键,故A错误;
B、金属在熔融态能导电,而化合物在熔融态能导电,则该化合物一定是离子化合物,其中一定含有离子键,故B正确;
C、N2分子中是氮氮叁键,而HCl分子中氢氯单键,氢不具有8电子稳定结构,故C错误;
D、干冰是分子晶体,其溶于水生成碳酸的过程中伴有化学键的断裂与形成,所以不仅是克服分子间作用力,故D错误;
故选B.
点评 本题考查化学键的类型、物质的导电性、8电子稳定结构等,难度不大,注意化学反应的实质是化学的断裂与形成的过程.


科目:高中化学 来源: 题型:实验题
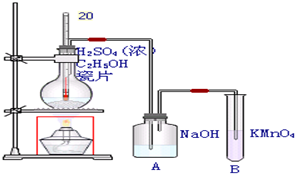
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 鉴定溴乙烷中存在溴元素的实验操作是先加入NaOH溶液,加热后再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45 kJ•mol-1 | B. | +32.7 kJ•mol-1 | C. | -45 kJ•mol-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数一定相同,质量数和中子数一定不同 | |
| B. | 化学性质几乎完全相同 | |
| C. | 一定都由质子、中子、电子构成 | |
| D. | 核电荷数,核外电子数一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com