

分析 (1)①海水晒盐通过蒸发、结晶制取食盐;
②以NaCl、CO2 和 NH3 为原料制取纯碱,第一步反应生成碳酸氢钠和氯化铵;
(2)I.电解海水反应中,阴极氢离子得到电子生成氢气,据此判断阴极产物;
II.根据图示可知,虚线部分只允许阴离子通过,为阴离子交换膜;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,离子浓度大的为浓水,离子浓度小的为淡水;
(3)I.吸收塔中碳酸根离子与溴单质反应生成溴离子、溴酸根离子和二氧化碳气体,反应③加入硫酸后,Br-、BrO3-反应生成溴单质,据此写出反应的离子方程式;
II.在①中溴单质浓度较小,通过吹出、吸收、酸化重新获得含Br2的溶液,可以富集溴,降低成本;
Ⅲ.温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来.
解答 解:(1)①由海水晒盐原理可知,盐田分为贮水池、蒸发池和结晶池,故答案为:蒸发;
②以NaCl、NH3、CO2和水等为原料制取NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,故答案为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;
(2)I.阴极上发生还原反应,水电离的氢离子得到电子生成氢气,同时生成氢氧化钠,故答案为:H2、NaOH;
II.图中虚线部分只允许阴离子通过,所以为阴离子交换膜;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度增大,离子浓度大的为浓水,所以浓水在B处排出,淡水在A处排出,
故答案为:阴;A;
(3)I.纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑,反应③加入硫酸后,Br-、BrO3-反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,
故答案为:5Br-+BrO3-+6H+=3Br2+3H2O;
II.从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,故答案为:富集溴,提高Br2的浓度;
Ⅲ.温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,则控制温度在90℃左右进行蒸馏,故答案为:温度过低,难以将溴蒸出,但温度过高,又会将大量的水蒸馏出来.
点评 本题以海水资源利用考查混合物分离提纯的综合应用,为高频考点,把握电解原理、氧化还原反应及混合物分离方法为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸 | |
| B. | 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤 | |
| C. | 除去NH4Cl固体中少量I2:加热,I2升华除去 | |
| D. | 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
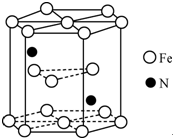 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

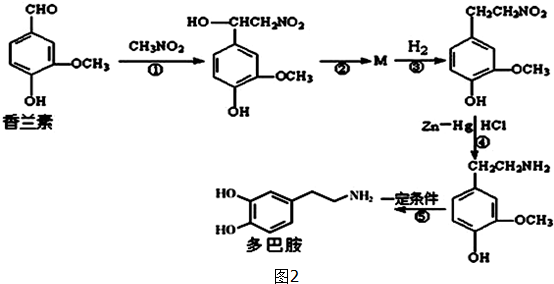
 .
. .
. .
.
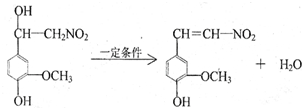 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
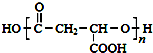 ,合成M的流程图如下:
,合成M的流程图如下: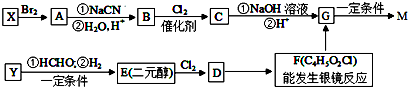
 ,
, .
.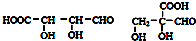 .
.查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下,
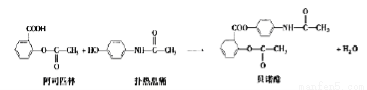
下列叙述错误的是
A.FeCl3溶液可区别阿司匹林和扑热息痛
B.1mol阿司匹林最多可消耗3molNaOH
C.常温下贝诺酯在水中的溶解度大干扑热息痛的
D.扑热息痛发生类似酯水解反应的产物之一分子式为C6H7NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com