
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=﹣870.3kJ•mol﹣1
(2)C(s)+O2(g)=CO2(g)△H2=﹣393.5kJ•mol﹣1
(3)H2(g)+ O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )kJ•mol﹣1.
|
| A. | +488.3 | B. | ﹣244.15 | C. | ﹣488.3 | D. | +244.15 |
科目:高中化学 来源: 题型:
在一定体积的18 mol /L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9 mol,则浓硫酸的实际体积 ( )
A.等于50mL B.大于50mL C.等于100mL D. 大于100Ml
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写
一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序
号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+
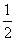 O2(g)
O2(g)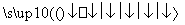 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二
转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次
转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化
器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸
收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目
的。用化学方程式表示其反应原理。(只写出2个方程式即可)_____________
__________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生 反应,说明亚硝酸钠具有 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具
有 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F====6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是 ,还原剂是 ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为 ,
反应中每生成0.1 mol H2,转移电子数为 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列过程中熵变的判断不正确的是( )
|
| A. | 溶解少量食盐于水中:△S>0 |
|
| B. | H2O(g)变成液态水:△S>0 |
|
| C. | 纯碳和氧气反应生成CO(g):△S>0 |
|
| D. | CaCO3(s)高温分解为CaO(s)和CO2(g):△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)⇌2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
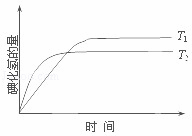
|
| A. | T1>T2,△H>0 | B. | T1>T2,△H<0 | C. | T1<T2,△H>0 | D. | T1<T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分离方法中,是利用密度不同达到分离的是( )
|
| A. | 利用蒸发皿,蒸发海水获得海盐 |
|
| B. | 煎中药时用水在煮沸条件下提取中药的有效成分 |
|
| C. | 把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣 |
|
| D. | 沙里淘金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表所列各组第I栏中的化学反应与第Ⅱ栏中的化学反应都可以用第Ⅲ栏中的离子方程式表示的是()
选项 第I栏 第Ⅱ栏 第Ⅲ栏
A 往少量NaOH溶液中投入铝片 往过量NaOH溶液中投入铝片 Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
B 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 Fe3++3OH﹣═Fe(OH)3↓
C NaHCO3溶液滴入Ca(OH)2溶液 NaHCO3溶液滴入NaOH溶液 OH﹣+HCO3﹣═CO32﹣+H2O
D 往NaOH溶液中通入过量CO2气体 往NaOH溶液中通入少量CO2气体 CO2+OH﹣═HCO3﹣
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com