
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱 | |
| B. | 熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 | |
| C. | NCl3分子中所有的原子均为8电子稳定结构 | |
| D. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
分析 A.非金属性越强,对应氢化物越稳定,但HF酸为弱酸,HCl、HBr、HI均为强酸;
B.熔融状态下能导电的化合物一定含离子,金属与非金属元素形成的化合物可能为共价化合物;
C.ABn分子中中心原子的族序数+成键数=8,满足所有原子为8电子稳定结构,氢化物除外;
D.NaHSO4晶体中阴离子为硫酸氢根离子,晶体中含离子键、共价键.
解答 解:A.非金属性F>Cl>Br>I,HF、HCl、HBr、HI的热稳定性依次减弱,但HF酸为弱酸,HCl、HBr、HI均为强酸,故A错误;
B.熔融状态下能导电的化合物一定含离子,一定含离子化合物;金属与非金属元素形成的化合物可能为共价化合物,如氯化铝为共价化合物,故B错误;
C.NCl3分子中N的族序数为5,成键数为3,则5+3=8,可知所有的原子均为8电子稳定结构,故C正确;
D.NaHSO4晶体中阴离子为硫酸氢根离子,晶体中含离子键、共价键,则阴、阳离子的个数是1:1,熔化时只破坏离子键,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、化学键、8电子稳定结构为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


 .设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
.设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、硅、硫等元素在自然界中只存在化合态 | |
| B. | 纯铁的抗腐蚀性能比生铁好 | |
| C. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 | |
| D. | 制备FeCl3不能采用将其溶液直接蒸干的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| B. | 向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 | |
| C. | 置换反应不一定都是氧化还原反应 | |
| D. | 标况下,NA个SO2分子和NA个SO3分子体积相同(NA表示阿伏加德罗常数值) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
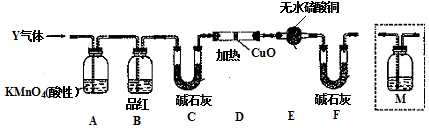
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.
现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙醇可被重铬酸钾氧化成乙酸,溶液由橙色变成绿色 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com