
| A. | 在平衡体系PCl3(g)?PCl3+Cl2(g)中加入一定量的${\;}_{\;}^{37}$Cl,达到平衡后”37Cl仅存在于五氯化鱗和氯气分子里,不可能存在于三氯化磷分子 | |
| B. | CH3C00H与H180-CH2CH3;发生酯化反应化是可逆反应,达到平衡后${\;}_{\;}^{18}$0仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 | |
| C. | CH2Br2没有同分异构体的事实证明了甲烷分子是碳原子为中心的正四面体结构 | |
| D. | 在氧气中完全燃烧后生成物只有C02和H2O的有机物不一定是烃 |
分析 A.化学反应的本质为旧键断裂,原子之间重新组合形成新的化学键.反应为可逆反应,平衡时PCl5、PCl3、Cl2三种物质都存在37Cl;
B.羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢;
C.若甲烷为平面型结构,其二氯代物有两种异构体,而正四面体的二氯甲烷不存在同分异构体;
D.根据元素守恒可知,烃及烃的含氧衍生物完全燃烧后生成物只有CO2和H2O.
解答 解:A.该反应为可逆反应,反应一段时间后又向其中加入37Cl2,反应过程中分子中化学键断裂,生成原子,原子之间重新组合形成新的化学键,生成新的物质,所以平衡时PCl5、PCl3、Cl2三种物质中都存在37Cl原子,故A错误;
B.乙酸与乙醇反应甲酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以乙酸与乙醇反应方程式为CH3COOH+CH3CH218OH?CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故B正确;
C.CH4分子中有四个等同的C-H键,可能有两种对称的结构:正四面体结构和平面正方形结构,若为平面正方形结构,二氯甲烷有两种同分异构体,而正四面体的二氯甲烷不存在同分异构体,故C正确,
D.烃及烃的含氧衍生物完全燃烧后生成物只有CO2和H2O,故D正确;
故选A.
点评 本题考查可逆反应特征、常见有机物的结构与性质等,难度不大,注意基础知识的理解掌握.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
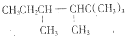 f.C8H10O2
f.C8H10O2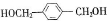 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 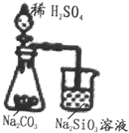 可以用业证明非金属性的相对强弱S>C>Si 可以用业证明非金属性的相对强弱S>C>Si | |
| B. | 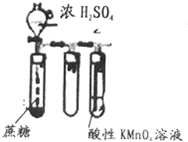 可以用来检验是否有还原性气体生成 可以用来检验是否有还原性气体生成 | |
| C. | 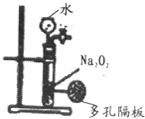 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 | |
| D. |  滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
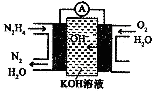 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com