
»ÆѧŹµŃéÖŠ£¬ČēŹ¹Ä³²½ÖŠµÄÓŠŗ¦²śĪļ×÷ĪŖĮķŅ»²½µÄ·“Ó¦Īļ£¬ŠĪ³ÉŅ»øöŃ»·£¬¾Ķ²»ŌŁĻņ»·¾³ÅÅ·ÅøĆÖÖÓŠŗ¦ĪļÖŹ”£ĄżČēøõµÄ»ÆŗĻĪļÓŠŅŌĻĀŃ»·¹ŲĻµ£ŗ
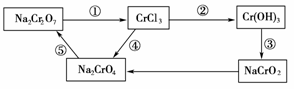 ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ(””””)
ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ(””””)
A£®ÉĻŹöĪļÖŹÖŠÖ»ÓŠNa2CrO4æÉ×÷Ńõ»Æ¼Į
B£®·¢Éś·“Ó¦¢Ż£¬Ņ»¶ØŅŖ¼ÓČėŃõ»Æ¼Į
C£®·¢Éś·“Ó¦¢ŁŹ±£¬ĻūŗÄNa2Cr2O7µÄøöŹżÓė ×ŖŅʵĵē×ÓŹżÖ®±ČĪŖ1”Ć6
D£®“Ó·“Ó¦¢ŚĄ“æ“£¬CrCl3²»ÄÜÓĆCr(OH)3ÓėŃĪĖį·“Ó¦Ą“ÖĘČ”
 Ķ¬²½Į·Ļ°ŗÓÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
Ķ¬²½Į·Ļ°ŗÓÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø Ķ¬²½Į·Ļ°Ī÷ÄĻŹ¦·¶“óѧ³ö°ęÉēĻµĮŠ“š°ø
Ķ¬²½Į·Ļ°Ī÷ÄĻŹ¦·¶“óѧ³ö°ęÉēĻµĮŠ“š°ø ²¹³äĻ°Ģā½ĖÕĻµĮŠ“š°ø
²¹³äĻ°Ģā½ĖÕĻµĮŠ“š°ø ѧĮ·æģ³µµĄæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
ѧĮ·æģ³µµĄæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¶ŌĻĀĮŠø÷ČÜŅŗÖŠ£¬Ī¢Į£µÄĪļÖŹµÄĮæÅØ¶Č¹ŲĻµ±ķŹöÕżČ·µÄŹĒ
A.0.1mol·L-1µÄ(NH4)2CO3ČÜŅŗÖŠ:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1µÄNaHCO3ČÜŅŗÖŠ:c(Na£«)=c(HCO3£)+c(H2CO3)+2c(CO32£)
C.½«0.2 mol·L-1 NaAČÜŅŗŗĶ0.1 mol·L-1ŃĪĖįµČĢå»ż»ģŗĻĖłµĆ¼īŠŌČÜŅŗÖŠ:c(Na£«)+c(H+)=c(A-)+c(Cl-)
D.ŌŚ25”ꏱ£¬1mol·L-1µÄCH3COONaČÜŅŗÖŠ:c(OH-)=c(H+)+c(CH3COOH)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
””Ķź³ÉĻĀĮŠ»Æѧ·½³ĢŹ½µÄÅäĘ½
””¢Å H2S + HNO3 ©¤©¤ H2SO4 + NO2 + H2O
””¢Ę C + H2SO4 ©¤©¤ SO2”ü + CO2”ü + H2O
””¢Ē Zn + HNO3 ©¤©¤ Zn(NO3)2 + NH4NO3 + H2O
””¢Č NaClO3 + FeSO4 + H2SO4 ©¤©¤ NaCl + Fe2(SO4)3 + H2O
””¢É Fe(OH)2+ O2+ H2O©¤©¤ Fe(OH)3
¢Ź KClO3+ HCl(ÅØ)£ KCl+ ClO2+ Cl2+ H2O
””¢Ė KMnO4 + HCl©¤©¤ KCl + MnCl2 + Cl2”ü + H2O
””¢Ģ Fe(NO3)3+ NaOH+ Cl2©¤©¤ Na2FeO4+ NaNO3+ NaCl+ H2O
¢Ķ P + KOH + H2O©¤©¤ KH2PO4 + PH3”ü
¢Ī KCl+ KClO3+ H2SO4©¤©¤ K2SO4+ Cl2”ü+ H2O
¢Ļ FeS2+ O2 £ Fe2O3+ SO2
¢Š H2C2O4+ KMnO4+ H2SO4©¤©¤ CO2+ K2SO4+ MnSO4+ H2O
¢Ń MnO2+ H++ Cl£©¤©¤ Mn2++ Cl2”ü+ H2O
¢Ņ Cu+ H++ NO3£©¤©¤ Cu2++ NO”ü+ H2O
¢Ó NO3”Ŗ+ Zn+ OH”Ŗ+ H2O©¤©¤ NH3+ Zn(OH)42£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖĻĀŹöČżøöŹµŃé¾łÄÜ·¢Éś»Æѧ·“Ó¦£ŗ
| ŹµŃé¢Ł | ŹµŃé¢Ś | ŹµŃé¢Ū |
| ½«Ģś¶¤·ÅČėĮņĖįĶČÜŅŗÖŠ | ĻņĮņĖįŃĒĢśČÜŅŗÖŠµĪČė¼øµĪÅØĻõĖį | ½«ĶĖæ·ÅČėĀČ»ÆĢśČÜŅŗÖŠ |
ĻĀĮŠÅŠ¶ĻÖŠÕżČ·µÄŹĒ(””””)
A£®ŹµŃé¢ŁÖŠĢś¶¤Ö»×÷»¹Ō¼Į B£®ŹµŃé¢ŚÖŠFe2£«¼ČĻŌŃõ»ÆŠŌÓÖĻŌ»¹ŌŠŌ
C£®ŹµŃé¢ŪÖŠ·¢ÉśÖĆ»»·“Ó¦ D£®ÉĻŹöŹµŃéÖ¤Ć÷Ńõ»ÆŠŌ£ŗFe3£«>Fe2£«>Cu2£«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĮ£×Ó²»¾ßÓŠŃõ»ÆŠŌµÄŹĒ£Ø £©A”¢Cl”Ŗ B”¢Cl2 C”¢H+ D”¢O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚĻĀĮŠ±ä»ÆÖŠ£¬ŠčŅŖ¼ÓČėŗĻŹŹµÄŃõ»Æ¼Į²ÅÄÜŹµĻֵďĒ (””””)”£
A£®HCl”śH2 B£®CO2”śCO C£®Fe2O3”śFe D£®Br£”śBr2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÅäĘ½ĻĀĮŠŃõ»Æ»¹Ō·“Ó¦·½³ĢŹ½£¬²¢±źĆ÷·“Ó¦¢Üµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄ攣
¢Ł H2S+
H2S+ H2SO3”Ŗ”Ŗ
H2SO3”Ŗ”Ŗ S”ż+
S”ż+ H2O
H2O
Ńõ»Æ²śĪļŹĒ_________£¬»¹Ō²śĪļŹĒ__________£¬¶žÕßÖŹĮæ±ČŹĒ________”£
¢Ś Cl2+
Cl2+ KOH”Ŗ”Ŗ
KOH”Ŗ”Ŗ KCl+
KCl+ KClO3+
KClO3+ H2O
H2O
Ńõ»Æ¼ĮŹĒ________£¬»¹Ō¼ĮŹĒ________£¬¶žÕßĪļÖŹµÄĮæÖ®±ČŹĒ__________”£
¢Ū KClO3+
KClO3+ HCl”Ŗ”Ŗ
HCl”Ŗ”Ŗ KCl+
KCl+ Cl2ӟ+
Cl2ӟ+ H2O
H2O
HClµÄ×÷ÓĆŹĒ________£¬±»»¹ŌµÄŌŖĖŲŹĒ__________£¬µ±·“Ó¦¹ż³ĢÖŠÓŠ3 £ķolµē×Ó×ŖŅĘŹ±£¬æɲśÉśĀČĘų________mol”£
¢Ü KIx+
KIx+ Cl2+
Cl2+ H2O”Ŗ”Ŗ
H2O”Ŗ”Ŗ KCl+
KCl+ HIO3+
HIO3+ HCl
HCl
ČōKIxÓėCl2µÄ»Æѧ¼ĘĮæŹżÖ®±ČĪŖ1”Ć8£¬Ōņx£½____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijŠ£Ķ¬Ń§ĪŖĢ½¾æBr2”¢I2ŗĶFe3£«µÄŃõ»ÆŠŌĒæČõ£¬½ųŠŠĮĖČēĻĀŹµŃ锣
ŹµŃé¢Ł£ŗȔɣĮæKIČÜŅŗÓŚŹŌ¹ÜÖŠ£¬ĻČ¼ÓČėäåĖ®”¢Õńµ“£¬ŌŁ¼ÓČėCCl4£¬Õńµ“ŗó¾²ÖĆ£¬¹Ū²ģµ½ĻĀ²ćŅŗĢå³Ź×ĻŗģÉ«£»
ŹµŃé¢Ś£ŗȔɣĮæFeSO4ČÜŅŗÓŚŹŌ¹ÜÖŠ£¬ĻČ¼ÓČėäåĖ®£¬Õńµ“£¬ŌŁ¼ĢŠųµĪ¼ÓĮ½µĪKSCNČÜŅŗ£¬Õńµ“£¬¹Ū²ģµ½ČÜŅŗ³ŹŗģÉ«”£
(1)°“ŅŖĒ󊓳öĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½
ŹµŃé¢Ł ”£
ŹµŃé¢Ś ”£
(2)ÓÉÉĻŹöĮ½øöŹµŃ飬¶ŌĪļÖŹµÄŃõ»ÆŠŌæÉŅŌµĆ³öµÄÕżČ·½įĀŪŹĒ________”£
A£®Br2>I2 B£®Fe3£«>Br2 C£®Br2>Fe3£« D£®I£>Br£
(3)ŅŃÖŖFe3£«µÄŃõ»ÆŠŌĒæÓŚI2£¬ĒėÄć“ÓĖłøųŹŌ¼ĮÖŠŃ”ŌńĖłŠčŹŌ¼Į£¬Éč¼ĘŅ»øöŹµŃé¼ÓŅŌÖ¤Ć÷”£(ĢįŹ¾£ŗĒėŠ“³öŹµŃé²½Öč”¢ĻÖĻó¼°½įĀŪ)
¢ŁFeCl3ČÜŅŗ””¢ŚµāĖ®””¢ŪKIČÜŅŗ””¢ÜĻ”H2SO4””¢Żµķ·ŪČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŗĻ³É°±·“Ó¦£ŗN2(g)£«3H2(g)
 2NH3(g)””¦¤H£½£92.4 kJ”¤mol£1£¬ŌŚ·“Ó¦¹ż³ĢÖŠ£¬Õż·“Ó¦ĖŁĀŹµÄ±ä»ÆČēĻĀĶ¼£ŗ
2NH3(g)””¦¤H£½£92.4 kJ”¤mol£1£¬ŌŚ·“Ó¦¹ż³ĢÖŠ£¬Õż·“Ó¦ĖŁĀŹµÄ±ä»ÆČēĻĀĶ¼£ŗ
””””””””””””””””””””””””””””
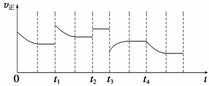
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A£®t1Ź±ÉżøßĮĖĪĀ¶Č B£®t2Ź±Ź¹ÓĆĮĖ“߻ƼĮ
C£®t3Ź±Ōö“óĮĖŃ¹Ēæ D£®t4Ź±½µµĶĮĖĪĀ¶Č
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com