
【题目】实验室制备一瓶纯净氯气的反应装置如图所示。关于实验操作或叙述正确的是( )

A.a中圆底烧瓶中需加入碎瓷片
B.b、c中所盛试剂依次为浓硫酸、饱和食盐水
C.d中黄绿色气体从下往上逐渐充满整个集气瓶
D.e中NaOH溶液可用浓氨水代替
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
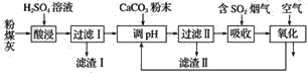
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
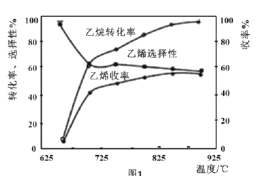
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___。
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:___。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。
(3)冷凝管中回流的主要物质除H2O外,还有___(填化学式)。
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,___,900℃煅烧。(已知:Zn与铝类似,能与NaOH溶液反应;Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0molL-1NaOH溶液、1.0molL-1HCl溶液、水)
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为___molL-1。
②通过计算确定aNaHSO2·bHCHOcH2O的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸的电离常数为1.8×10-5。向20mL2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如图所示。下列说法正确的是( )

A.a点水电离出的c(H+)=6.0×10-3mol/L
B.b点c(CH3COOH)>c(Na+)>c(CH3COO-)
C.c点恰好完全反应,溶液中无CH3COOH
D.d点c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小组设计如图装置制备NOC1。回答下列相关问题:

(1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为___。
(2)装置乙中的液体为___,装置丙作用是___。
(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作目的是___。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是___(用化学方程式表示)。
(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250mL溶液;取25.00mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为24.00mL。滴定终点的现象是___,亚硝酰氯(NOCl)的纯度为___。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
A | B | C | D |
| |
X中试剂 | 水 | 浓盐酸 | 双氧水 | 碘水 | |
Y中试剂 | Fe | MnO2 | MnO2 | NaBr | |
气体 | H2 | Cl2 | O2 | Br2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com