
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
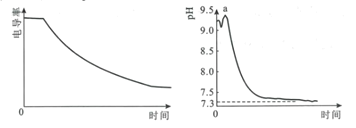
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
科目:高中化学 来源: 题型:
【题目】一种制氢技术原理如图所示,下列说法正确的是( )
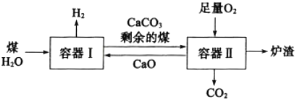
A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应
C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3
D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
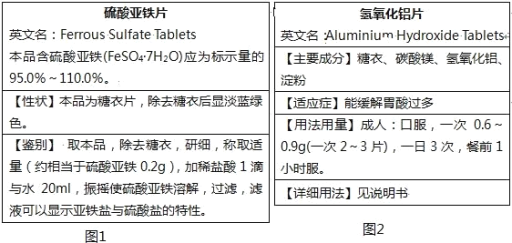
(1)根据“硫酸亚铁片”标签如图1回答:
①硫酸亚铁片中,糖衣的作用是_______;
②检验硫酸亚铁是否被氧化的试剂是_______;
③硫酸盐的鉴别反应的离子方程式是______;
④鉴别中,“加稀盐酸1滴”的作用是_______(选填序号);
A.防止亚铁离子被氧化 B.抑制亚铁离子水解
(2)根据氢氧化铝片标签如图2回答:
①能缓解胃酸过多的有效成分是______;
②写出氢氧化铝中和胃酸反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不属于四种基本反应类型的氧化还原反应的是( )
A.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Fe+CuSO4=Cu+FeSO4
D.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断,化学反应速率最快的是 ( )
A.v(H2)=0.2 mol·L-1·min-1B.v(H2)=0.04 mol·L-1·s-1
C.v(N2)=0.01 mol·L-1·s-1D.v(N2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从钴渣[含Co(OH)3、Fe(OH)3等]中回收钴的两种方法如下:
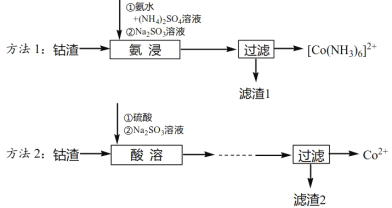
已知:
①Ksp[Co(OH)3]=1.6×10-44,Ksp[Co(OH)2]=6.3×10-15,Ksp[Fe(OH)3]=4.0×10-38。
②碱性条件下,Fe(OH)3不与亚硫酸钠反应;Fe3++NH3→不发生类似Co2+、Co3+的配位化学反应。
请回答下列问题:
(1)方法1“氨浸”时用的氨水的质量百分数为a,密度为ρg·cm-3,该氨水的物质的量浓度为_____mol·L-1,“氨浸”过程中发生反应的离子方程式为_______。
(2)方法1“氨浸”时,未加Na2SO3溶液和加入Na2SO3溶液时的钴浸出率如图1所示。请解释两种情况下钴浸出率不同的原因:______。
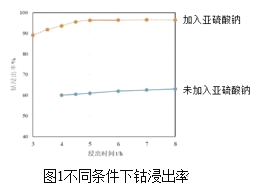
(3)方法1中,浸出温度对钴浸出率的影响如图2所示,工业上选择50℃而不是更高温度的可能的原因是_____。
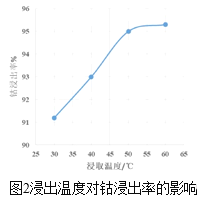
(4)方法2中,为提高酸溶速率,可采取的措施是______(写出一条即可)。
(5)对比方法1和方法2,从物质分离的角度分析方法1的优点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
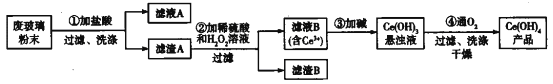
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com