

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | 最高价氧化物对应的水化物的酸性W强于X | |
| D. | Y元素非金属性比W元素的非金属性强 |
分析 根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体;
B.Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析;
C.同一主族中,原子序数越大,非金属性越强,最高价含氧酸的酸性越强.
D.同周期中,从左到右,元素的非金属性逐渐增强.
解答 解:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.常压下S、P为固体,而Br为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误;
B.Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C.W、X位于同一主族,非金属性W<X,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应的水化物的酸性W小于X,故C错误;
D.同周期中,从左到右,元素的非金属性逐渐增强,即Y元素非金属性比W元素的非金属性强,故D正确;
故选D.
点评 本题考查元素周期表位构性的相互关系,题目难度不大,明确原子结构与元素周期表的关系为解答关键,注意元素的性质的递变规律及其应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
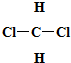 和
和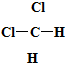 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和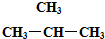
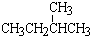 ;
; ③
③ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期第IA族 | B. | 第三周期第IVA族 | C. | 第二周期第VA族 | D. | 第三周期第VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | mg该原子中含有aNA个原子 | |
| C. | mg该原子的物质的量一定是$\frac{m}{a{N}_{A}}$mol | |
| D. | 阿伏加德罗常数NA=$\frac{12}{α}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com